
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Задачи и методы аналитической химииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ЛЕКЦИЯ № 1
Классификация методов анализа а) по характеру измеряемого свойства различают химические, физические и биологические методы. В основе химических методов лежат химические реакции. К химическим методам по современной классификации относят физико-химические методы. Физические методы основаны на измерении какого-либо физического свойства системы (например, потенциала, электропроводности, оптической плотности). Физико-химические и химические методы объединяют в инструментальные методы анализа (ИМА). Биологические методы основаны на биологических- процессах. б) по способу выполнения реакции делятся на реакции «мокрым» и «сухим» путем. Реакции проводимые «мокрым» путем делятся на пробирочные, капельные и микрокристаллоскопические. К реакциям, выполняемым «сухим» путем относятся реакция окрашивания пламени и метод растирания твердого исследуемого вещества с твердым реагентом. в) по видам анализа различают фазовый, молекулярный, изотопный, элементный и функциональный анализы. г) по количеству анализируемого вещества различают макро-, полумикро-, микро-, ультромикро- и субмикрометоды. В макрометоде содержание определяемого вещества составляет ~1 г, в полумикрометоде ~0,01 г, в микрометоде от 0,01 до 0,001 г, в ультромикрометоде 10-6 – 10-9 г, в субультромикрометоде - 10-9 – 10-12 г.
Лекция №2 ЛЕКЦИЯ № 3
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ В АНАЛИТИЧЕСКОЙ ХИМИИ План: 1. Определение комплексных соединений (КС), тип связи, строение, координационное число, характеристика комплексообразователя (на самостоятельное изучение). 2. Классификация комплексных соединений (самостоятельное изучение). 3. Термодинамическая и кинетическая устойчивость КС. 4. Константы образования (устойчивости) КС. 5. Расчет равновесной концентрации и молярной доли компонента. Конкурирующие реакции комплексообразования. 6. Функция образования. 7. Хелаты (внутрикомплексные соединения-ВКС).
3. Термодинамическая устойчивость характеризует возможность образования комплекса и превращения его в другое КС. Кинетическая устойчивость характеризует устойчивость комплекса во времени. В зависимости от скорости обмена иногда образуются инертные или лабильные комплексы. Лабильные комплексы – это такие комплексы, в которых обмен лиганда происходит очень быстро и равновесие устанавливается в течение времени меньше 1 мин. Инертные комплексы – это такие комплексы, в которых обмен лиганда происходит очень медленно и равновесие устанавливается в течение времени больше 1 мин или даже в течение суток. s- и p- элементы образуют лобильные комплексы, d-элементы – инертные комплексы. Для КС характерны два типа диссоциации: по типу сильного электролита (по внешней координационной сфере) и по типу слабого электролита (по внутренней координационной сфере). [Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl- [Ag(NH3)2]+ ↔ Ag+ + 2NH3
4. Образование и диссоциация комплекса происходит ступенчато. Устойчивость КС количественно характеризуется константой образования β. M + L ↔ ML ML + L ↔ ML2
MLn-1 + L ↔ MLn В справочниках приводятся суммарные константы образования, которые представляют собой произведение ступенчатых констант образования.
Найдем связь между
βn зависит от природы, температуры, I. При протекании конкурирующих реакций с участием комплексообразователя или лиганда равновесие в растворе комплексных соединений характеризуется условной константой устойчивости (
5. Пример. Рассчитать равновесную концентрацию ионов Ag+ в 0,001 М растворе нитрата серебра, содержащем 2М аммиака. В присутствии аммиака протекают конкурирующие реакции комплексообразования: Ag+ + NH3 ↔ Ag(NH3)+ Ag+ + 2NH3 ↔ Ag(NH3)2+
Запишем уравнение материального баланса: СAg+ = [Ag+] + [Ag(NH3)+] + [Ag(NH3)2+] Концентрации [Ag(NH3)+] и [Ag(NH3)2+] выражаем из констант устойчивости β1 и β2 и подставляем в уравнение материального баланса: [Ag(NH3)+] = β1∙[Ag+] + [NH3] [Ag(NH3)2+] = β2∙[Ag+] + [NH3]2 СAg+ = [Ag+] + β1[Ag+] + [NH3] + β2[Ag+] + [NH3]2 = [Ag+] (1+ β1[NH3] + β2[NH3]2) Определяем [Ag+]:
Находим Чем сильнее α-коэффициент отклоняется от 1, те более прочным является образующийся комплекс.
6. Важной характеристикой реакции комплексообразования является функция образования ( Функция образования (
7. Хелаты – это циклические соединения. К хелатам относятся внутрикомплексные соединения (ВКС). Каждое ВКС является хелатом, но не каждый хелат является ВКС. ВКС – это соединения, в которых ион металла связан с лигандами одновременно двумя типами связи: донорно-акцепторной и валентной. ВКС – это хелат, в котором замыкание цикла сопровождается вытеснением из кислотных функциональных групп одного или нескольких протонов ионом металла. Органическое соединение содержит две группы: солеобразующую и комплексообразующую. Донорно-акцепторная связь образуется за счет комплексообразующей группы. Валентная - за счет солеобразующей группы.
Комплексообразующие и солеобразующие группы должны быть расположены в молекуле органического соединения в орто -положении, чтобы не было стерических затруднений при образовании комплекса.
Устойчивость ВКС Наиболее устойчивыми являются 5и 6-членные циклы 9правило циклов Чугаева). Чем больше число циклов замыкается в ионе металла, тем более устойчивым является ВКС.
Свойства ВКС: а) образуют интенсивно окрашенные соединения: б) обладают высокой прочностью; в) мало растворимы в воде, хорошо растворяются в органических растворителях.
ЛЕКЦИЯ № 4 ЛЕКЦИЯ №5 КИСЛОТНО-ОСНОВНЫЕ РЕАКЦИИ 1. недостатки теории Аррениуса 2. Протолитическая теория кислот и оснований Бренстеда-Лоури. а) кислоты, основания, амфолиты; б)сопряженные кислотно-основные пары и их взаимодействие; в) перенос протонов, взаимодействие двух кислотно-основных пар; г) классификация растворителей по донорно-акцепторным свойствам; д) нивелирующий и дифференцирурующий эффекты растворителя; е) константы кислотности и основности, связь между ними.
1. Первой теорией кислот и оснований была теория Аррениуса, в основе которой лежит электролитическая диссоциация веществ в водных растворах. Недостатками этой теории являются: 1) не учитывается влияние растворителя в реакциях кислот и оснований; 2) теория применима только к водным растворам; 3) протон не может существовать в свободном виде, как это требует теория.
2. Всеобщее признание получила протолитическая теория кислот и оснований Бренстеда-Лоури. Кислоты – соединения, способные отдавать протон. Основания – соединения, способные присоединять протон. Кислотами и основаниями могут быть не только молекулярные частицы, но и заряженные. Молекулярные кислоты: HCl = H+ + Cl- CH3COOH ↔CH3COO- + H+ H2O ↔ H+ + OH- Заряженные кислоты: NH4+ ↔ NH3 + H+ H2PO4- ↔ H+ + HPO42- Молекулярные основания: NaOH ↔ Na+ + OH- OH- + H+ ↔H2O Заряженные основания: CH3COO- + H+ ↔ CH3COOH HPO42- + H+ ↔ H2PO4- [Al(H2O)5OH]2+ + H+ ↔ [Al(H2O)6]3+
Амфолиты – вещества, способные как присоединять, так и отдавать протон.
H2O ↔ H+ + OH- H2O + H+ ↔ H3O+ NH3 ↔ H+ + NH2- NH3 + H+ ↔ NH4+ Кислоты, основания, амфолиты называются протолитами. По теории Аррениуса кислоты и основания не связаны между собой, по теории Бренстеда-Лоури, они связаны между собой. Кислота ↔ протон ↔ основание В реальных условиях эти полуреакции не могут протекать: HA ↔ H+ + A- B+ H+ ↔ BH+ Протон в растворе в свободном виде не может существовать, протон отщепляется в том случае, если в системе есть основание, которое присоединяет этот протон. Происходит перенос протона от одной кислотно-основной пары к другой. HA + B ↔ A- + BH+ кис.I осн. II осн. I кис. II Протолитическая реакция представляет собой взаимодействие двух кислотно-основных пар, одну кислотно-основную пару представляет протолит, другую – растворитель. Направление переноса протона зависит от донорно-акцепторных свойств вещества и растворителя. CH3COOH + H2O ↔ CH3COO- + H3O+ Акцепторные свойства у H2O выражены сильнее, чем у CH3COOH, среда кислая NH3 + H2O ↔ NH4+ +OH- Акцепторные свойства у NH3 выражены сильнее, чем у H2O. Протон переносится от H2O к NH3, среда щелочная. По теории Бренстеда-Лоури диссоциация кислот и оснований предсталяет кислотно-основное взаимодействие, которое осуществляется за счет переноса протона от кислоты к основанию и образуются новые кислоты и основания. По кислотно-основным свойствам растворители делят на активные, неактивные (апротонные).
Апротонные растворители не обладают ни кислотными, ни основными свойствами. К ним относятся CCl4, CHCl3, C6H6, C6H14, CS2, C6H12. Активные растворители делятся на протогенные, протофильные, амфипротные.
Протогенные (кислотные) растворители способны к отдаче протона (H2SO4, CH3COOH, ClCH2COOH, H3PO4 и т.д.
Протофильные (основные) растворители способны к присоединению протона (NH3, простые эфиры, (C2H5)2NH, C5H5N).
Амфипротные растворители способны как к отдаче, так и присоединению протона (H2O, спирты, карбоновые кислоты, кетоны) Для амфипротных растворителей характерна реакция автопротолиза.
Автопротолиз – самоионизация растворителя, когда одна молекула растворителя проявляет свойства кислоты, другая – основания H2O + H2O ↔ H3O+ + OH- В общем виде 2SH ↔SH2+ + S- лионий хелат
KSH определяет протяженность шкалы pH. pH – это отрицательный логарифм активности иона лиония:
pH – это отрицательный логарифм активности иона гидроксония:
Для разбавленных растворов активность можно заменить концентрацией, тогда pH = -lg[H+]. Сила кислоты и основания в значительной степени зависит от кислотно-основных свойств растворителя. Силу протолитов и их свойства сравнивают по отношению к одному и тому же растворителю (например, к H2O). В воде такие кислоты, как HClO4, HCl, HNO3, H2SO4 невелируются и имеют одинаковую силу на уровне иона H3O+ HClO4 + H2O ↔ H3O+ + ClO4- HCl + H2O ↔ H3O+ + Cl- HNO3 + H2O ↔ H3O+ + NO3- H2SO4 + H2O ↔ H3O+ + HSO4- У HCOOH акцепторные свойства почти такие же, как у воды. Поэтому протон не переносится. HCOOH в водном растворе является слабой кислотой, может существовать в молекулярной форме и в виде ионов. Вместо H2O возьмем другой растворитель, например, NH3. У него акцепторные свойства сильнее выражены, чем у H2O. NH3 может забирать протон и у HCOOH. В жидком NH3 сила кислот нивелируется до силы NH4+, более слабого, чем H3O-. HClO4 + NH3 ↔ NH4+ + ClO4- HCl + NH3 ↔ NH4+ + Cl- HCOOH + NH3 ↔ NH4+ + HCOO- Чем сильнее выражены акцепторные свойства ратсворителя, тем на более широкий круг распространяется его нивелирующее действие. В ледяной уксусной кислоте HClO4 легче отдает протон, чем HCl. (KHClO4 = 10-4, KHCl =10-7). Выводы: 1. Кислоты протолиты нивелируются в основных растворителях, дифференцируются – в кислотных растворителях. 2. Основания – протолиты нивелируются в кислотных растворителях, дифференцируются - в основных. Силу кислот и оснований характеризуют константами кислотности и основности. HA + H2O ↔ H3O+ + A-
A-+ H2O ↔ HA + OH-
Из (2) находим aHA и подставляем в (1):
ЛЕКЦИЯ №6 БУФЕРНЫЕ РАСТВОРЫ
План: 1. Определение буферных растворов. Типы буферных растворов. 2. Механизм буферного действия. 3. Вычисление pH буферных растворов 4. Буферная емкость 5. Применение в анализе
1. Буферными называются растворы, которые не изменяют заметно pH при разбавлении и при добавлении небольших количеств растворов сильных кислот и оснований. Буферный раствор представляет собой сопряженную кислотно0основную пару. Типы буферных растворов: а) ацетатный –CH3COOH и CH3COONa б) аммонийный – NH3∙H2O и NH4Cl в) формиатный – HCOOH и HCOONa г) фосфатный – Na2HPO4 и NaH2PO4 д) карбонатный – Na2CO3 и NaHCO3 е) индивидуальные соединения – раствор буры содержит эквимолярные количества H3BO3 и сопряженного основания BO2-; - концентрированные растворы сильных кислот и оснований. Сопряженными системами являются H3O+/H2O – для сильных кислот; OH-/H2O – для сильных оснований.
2. Механизм буферного действия состоит в том, что вводимая сильная кислота или сильное основание связывают компоненты буферной смеси в малодиссоциирующие соединения. CH3COOH + NaOH ↔ CH3COONa + H2O CH3COOH + OH- ↔ CH3COO- + H2O CH3COONa + HCl ↔ CH3COOH + NaCl CH3COO- + H+ ↔ CH3COOH Суммарная концентрация CH3COONa и CH3COOH сохраняется, а меняется только соотношение При разбавлении одновременно действуют два взаимно компенсирующих друг друга эффекта. За счет разбавления уменьшается концентрация кислоты и увеличивается степень диссоциации CH3COOH.
3. Вывод формулы
Эти две формулы практически ничем не отличаются. Для водных растворов удобнее пользоваться уравнением Аррениуса. 4. Чтобы буферного раствора не изменился, можно к нему добавлять только определенное количество сильной кислоты и сильного основания. Буферный раствор обладает буферной емкостью. Буферная емкость – число молей эквивалентов сильной кислоты или сильного основания, которые нужно добавить, чтобы pH раствора изменился на единицу. Буферная емкость определяется по формуле:
π зависит от суммарной концентрации компонентов и соотношения их концентраций. Чем больше концентрация компонентов, тем больше буферная емкость.
Тема: Окислительно-восстановительные реакции в аналитической химии. План: 1. Стандартный и формальный потенциалы. 2. Уравнение Нернста. 3. Влияние различных факторов на величину потенциала и направление реакции. 4. Константа равновесия и ее связь со стандартным потенциалом (самостоятельно). Для оценки окислительно-восстановительной способности окислителей и восстановителей служит потенциал. Потенциал является мерой сродства к электрону. Чем больше сродство к электрону, тем сильнее выражены окислительные свойства. В процессе окислительно-восстановительных реакций (ОВР) накапливаются как окислители, так и восстановители, т.е. образуется сопряженная окислительно-восстановительная пара. Например, Br2 + 2ē ↔ Br2/ 2Br-. Происходит перенос электрона от восстановителя к окислителю. Определить абсолютное значение потенциала отдельной окислительно-восстановительной пары невозможно, поэтому потенциализмеряют относительного стандартного водородного электрода (СВЭ). СВЭ представляет собой платиновую пластинку, покрытую мелкораздробленной платиновой чернью, и опущенную в 1 н раствор H2SO4. Через чернь пропускают газообразный H2 под давлением 1 атм. В основе работы СВЭ лежит реакция: 2H+ +2ē ↔ H2. Потенциал у СВЭ условно принят равным нулю. Чтобы получить стандартные условия выбираем систему, у которой aок = aвос = 1 моль/л и измеряем. Потенциал системы, в которой aок = aвос = 1 моль/л, и измеренный относительно СВЭ называется стандартным (Е°). Е° принимать знаки «+» и «-». Знаки при потенциалах показывают, окислителем или восстановителем является данная пара по отношению к СВЭ. Если знак (+), то система является окислителем по отношению к СВЭ. Если знак (-), то система является восстановителем по отношению к СВЭ. Чем выше положительное значение потенциала системы, тем большей окислительной способностью обладает система. Чем более отрицательное значение потенциала системы, тем большей восстановительной способностью обладает система. Система с большим значением потенциала является окислителем по отношению к системе с меньшим значением потенциала. Чем больше разность потенциалов двух пар, тем менее обратима реакция. Чтобы реакция протекала количественно (на 99,9%), разность потенциалов должна быть ∆E ≥ 0.3 B. В реальных условиях aок и aвос форм отличаются от единицы. Потенциал системы, в которой активности aок и aвос форм отличается от единицы называется равновесным (EOx/Red). Зависимость равновесного потенциала от aок и aвос форм выражается через уравнение Нернста:
EOx/Red зависит от природы растворителя, температуры, γ, α. a = γ∙ c∙α Тогда Формальный потенциал – это потенциал системы, в которой COx = CRed = 1моль/л. E°/ зависит от природы, температуры, I и α. Какую формулу используют в расчетах?
Обычно мы работаем с разбавленными растворами, и при отсутствии глубокопротекающих конкурирующих реакций, используем формулу:
На величину потенциала влияет концентрация ионов водорода. При этом различают три случая: 1) H+ непосредственно входит в уравнение Нернста; MnO4- +8H+ +5ē = Mn2+ + 4H2O
2) H+ непосредственно не участвует в реакциях окисления-восстановления, но вызывает конкурирующую реакцию протонирования, тем самым влияет на величину потенциала. S кислой среде протонируется S2- + H+→ HS- → H2S Уравнение материального баланса:
H+ не влияет на величину потенциала, если в ОВР не участвует кислородсодержащий окислитель и отсутствуют конкурирующие реакции. На величину потенциала влияет конкурирующая реакция осадкообразования. Например, рассмотрим иодометрическое определение меди.
Система йода является окислителем по отношению к системе меди. По стандартным потенциалам должна идти реакция: Cu2+ + I2 → Cu2+ + 2I- На самом деле реакция идет в обратном направлении, что связано с образованием малорастворимого соединения CuI.
Потенциал системы за счет образования осадка CuI увеличивается.
Протекает реакция: 2Cu2+ +4I- = 2CuI↓ + I2 На величину потенциала влияет конкурирующая реакция комплексообразования. Рассмотрим систему:
Должна идти следующая реакция: Co3+ + NO → Co2+ + NO2- На самом деле идет реакция: (CH3COO)2 +7KNO2 +2CH3COOH = 4CH3COOK +K3[Co(NO2)6] +NO+H2O
ЛЕКЦИЯ №7 Метод добавок В этом случае анализируют не искусственную смесь, а сам сплав. Берут навеску сплава, его растворяют в кислоте и определяют содержание никеля - Погрешность рассчитывают по формуле:
Анализ считается идеальным, если x совпадает с xдоб. Результаты считаются правильными, если D невелика. Метод является более точным. Независимый метод При использовании этого метода необходимо соблюдать 2 условия: а) выбранный для сравнения метод должен дать правильный результат; б) должен принципиально отличаться от изучаемого метода. Например, при определении содержания никеля в латуни комплексонометричесим методом для сравнения используют гравиметрический метод. Содержание Ni, определенное гравиметрическим методом, берется за истинное.
ЛЕКЦИЯ № 8 Самым надежным методом выявления систематических погрешностей является метод стандартных образцов. Стандартные образцы (СО) – это образцы из материала, состав и свойства которого надежно установлены и удостоверены государственным учреждением. Каждый СО снабжен паспортом, в котором указывается истинное содержание компонента. Готовят СО I разряда для металлов, сплавов, горных пород, лекарственных препаратов. СО I разряда готовят специализированные лаборатории. Затем их рассылают не менее, чем в 25-30 лабораторий страны. В каждой лаборатории образец анализируется не менее чем двумя различными методами и двумя аналитиками. Проводят пять параллельных определений и три определения методом добавок. Полученные результаты посылают в специализированную лабораторию и обрабатываются методами математической статистики. Труднее всего готовить СО II разряда для пищевых продуктов и объектов окружающей среды. На основе реальных объектов готовят СО и содержание их определяют по СО I разряда. 6. Для оценки правильности результатов анализа СО можно использовать в том случае, когда состав и свойства анализируемой пробы и СО совпадают. Основные понятия химической метрологии Генеральная совокупность - гипотетическая совокупность всех мыслимых результатов от -∞ до +∞. Выборочная совокупность 9выборка) - реальное число измерений, которое имеет исследователь (обычно n=3-5). При n > 20-30 с достаточной степенью приближения и при n >50-100 с хорошим приближением выборка переходит в генеральную совокупность. При наличии генеральной совокупности результаты химического анализа подчиняются закону нормального распределения (ЗНР). Для обработки малого числа измерений используют распределение Стьюдента. Основными параметрами ЗНР являются: математическое ожидание (μ), дисперсия σ2, стандартное отклонение. Математическое ожидание (генеральное среднее) – среднее из бесконечного числа измерений. При отсутствии систематических погрешностей, μ равно истинному содержанию. Дисперсия σ2 характеризует разброс результатов относительно μ. Стандартное отклонение σ тоже характеризует разброс результатов относительно μ. Основными параметрами t-распределения являются дисперсия V, стандартное отклонение S и относительное стандартное отклонение Sr. Дисперсия V характеризует разброс результатов относительно среднего арифметического. S и Sr тоже характеризуют рассеяние результатов параллельных определений.
t-распределение зависит от объема выборки, т.е. от числа параллельных определений. Для того чтобы исключить это влияние вводится понятии степень свободы f=n-1 (исключается одна степень свободы, связанная с определением среднего). ЗНР связывает вероятность появления отклонения с величиной отклонения (x- μ).
t-распределение связывает между собой ширину доверительного интервала, доверительную вероятность и объем выборочной совокупности. Графическое изображение распределения случайных погрешностей называется кривой распределения.
Выводы по кривой распределения: 1. Кривые распределения зависят от величины дисперсии, и, следовательно, от стандартного отклонения σ. Чем больше σ, тем больше разброс результатов. 2. Симметричные кривые показывают равную вероятность появления как отрицательных, так и положительных погрешностей. 3. Вероятность появления малых погрешностей значительно больше, чем вероятность появления больших погрешностей. Кривые t-распределения зависят от тех же факторов, что и кривые ЗНР. Кроме этого они еще зависят от числа измерений. По t-распределению можно определить доверительный интервал ∆x. Эта область, внутри, которой находится истинное значение измеряемой величины с заданной доверительной вероятностью
Доверительная вероятность p – это вероятность попадания случайной величины в заданный доверительный интервал. Обычно при расчетах p=0,95. Если известно истинное содержание x компонента, то можно и охарактеризовать правильность анализа.
8. Прежде всего проводить статистическую обработку, необходимо выявить промахи и исключить их из результатов анализа. Для этого используют θ-критерий при n≥5.
x2 – соседний с промахом результат xmax и xmin –максимальное и минимальное значение в выборке. xmax - xmin – размах варьирования θэксп сравнивают с θтабл, если θэксп > θтабл, то результат является промахом, его исключают. Если θэксп < θтабл, то результат оставляют в выборке.
9. Чтобы оценить сходимость результатов анализа одного и того же объекта, полученные двумя разными методами, в двух разных лабораториях проводят сравнение дисперсий двух методов. Для этого используют критерий Фишера (F-критерий). Fэксп. сравнивают с Fтабл учитывая, что числа степеней свободы выборки с большей дисперсией располагается в горизонтальном ряду таблиц, а числа степеней свободы выборки с меньшей дисперсией – в вертикальном ряду. Если Fэксп < Fтабл, различие между двумя выборками незначимо. Если Fэксп > Fтабл, различие между двумя выборками значимо, результаты двух методов отличаются по воспроизводимости. Если расхождение между дисперсиями незначимо, сравнивают
Сравнивают tэксп c tтабл при p=0,95 и f=n1 + n2 – 2. Если tэксп < tтабл, то расхождение незначимо, результаты двух выборок можно объединить в одну выборку. Если tэксп > tтабл, расхождение значимо, следует искать систематическую погрешность. 10. Чтобы аналитическая лаборатория могла проводить анализы и результаты анализа были признаны, она должна пройти аттестацию. По результатам аттестации лаборатории присваивается категория. При аттестации используют поэлементную и комплексную поверку. Поэлементная поверка – проверяют мерную посуду, аналитические весы и другие приборы. Комплексная поверка – проверяют правильность результатов анализа. работникам лаборатории выдают СО, их анализируют несколькими надежными методами. Полученные результаты сравнивают с паспортными данными СО.
11. Основными характеристиками метода являются точность, чувствительность, избирательность. Чувствительность характеризуется пределом обнаружения и нижней границей определяемых содержаний. Предел обнаружения –это наименьшее содержание, при котором по данной методике можно обнаружить присутствие компонента с заданной доверительной вероятностью. Предел обнаружения задается в виде cmin и mmin. mmin –минимальное количество, при котором данный компонент может быть обнаружен с достаточно высокой заданной вероятностью. cmin
S – коэффициент чувствительности; Sфон – стандартное отклонение аналитического сигнала фона. S<
|
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 694; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.211.116 (0.012 с.) |


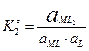

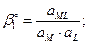

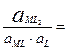



 не зависит от активности компонентов и комплексных частиц, зависит от природы и температуры. Активность комплексных частиц редко известна, поэтому чаще пользуются концентрационной константой образования (βn).
не зависит от активности компонентов и комплексных частиц, зависит от природы и температуры. Активность комплексных частиц редко известна, поэтому чаще пользуются концентрационной константой образования (βn).
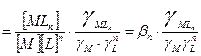
 ).
). [MLn] выражаем из
[MLn] выражаем из  и подставляем
и подставляем
 отсюда
отсюда 


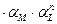




 ).
).


 ,
, 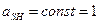



 - константа кислотности (1)
- константа кислотности (1) - константа основности (2)
- константа основности (2)

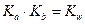
 , которое практически не влияет на pH.
, которое практически не влияет на pH.
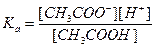













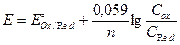
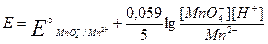
 и
и
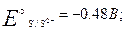 в кислой среде
в кислой среде 








 1. Точно такое же количество навески растворяют и вводят точно известное количество Ni –xдоб. Проводят анализ образца с добавкой и находят содержание никеля
1. Точно такое же количество навески растворяют и вводят точно известное количество Ni –xдоб. Проводят анализ образца с добавкой и находят содержание никеля 





 ≥
≥  систематическая погрешность есть
систематическая погрешность есть ; x1 –результат который считается промахом.
; x1 –результат который считается промахом. V1>V2.
V1>V2. и
и 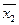 двух методов:
двух методов: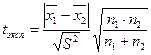

 - средняя дисперсия
- средняя дисперсия



