
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Комплексные соединения в аналитической
ХИМИИ План: 1. Определение комплексных соединений (КС), тип связи, строение, координационное число, характеристика комплексообразователя (на самостоятельное изучение). 2. Классификация комплексных соединений (самостоятельное изучение). 3. Термодинамическая и кинетическая устойчивость КС. 4. Константы образования (устойчивости) КС. 5. Расчет равновесной концентрации и молярной доли компонента. Конкурирующие реакции комплексообразования. 6. Функция образования. 7. Хелаты (внутрикомплексные соединения-ВКС).
3. Термодинамическая устойчивость характеризует возможность образования комплекса и превращения его в другое КС. Кинетическая устойчивость характеризует устойчивость комплекса во времени. В зависимости от скорости обмена иногда образуются инертные или лабильные комплексы. Лабильные комплексы – это такие комплексы, в которых обмен лиганда происходит очень быстро и равновесие устанавливается в течение времени меньше 1 мин. Инертные комплексы – это такие комплексы, в которых обмен лиганда происходит очень медленно и равновесие устанавливается в течение времени больше 1 мин или даже в течение суток. s- и p- элементы образуют лобильные комплексы, d-элементы – инертные комплексы. Для КС характерны два типа диссоциации: по типу сильного электролита (по внешней координационной сфере) и по типу слабого электролита (по внутренней координационной сфере). [Ag(NH3)2]Cl ↔ [Ag(NH3)2]+ + Cl- [Ag(NH3)2]+ ↔ Ag+ + 2NH3
4. Образование и диссоциация комплекса происходит ступенчато. Устойчивость КС количественно характеризуется константой образования β. M + L ↔ ML ML + L ↔ ML2
MLn-1 + L ↔ MLn В справочниках приводятся суммарные константы образования, которые представляют собой произведение ступенчатых констант образования.
Найдем связь между
βn зависит от природы, температуры, I. При протекании конкурирующих реакций с участием комплексообразователя или лиганда равновесие в растворе комплексных соединений характеризуется условной константой устойчивости (
5. Пример. Рассчитать равновесную концентрацию ионов Ag+ в 0,001 М растворе нитрата серебра, содержащем 2М аммиака. В присутствии аммиака протекают конкурирующие реакции комплексообразования: Ag+ + NH3 ↔ Ag(NH3)+ Ag+ + 2NH3 ↔ Ag(NH3)2+
Запишем уравнение материального баланса: СAg+ = [Ag+] + [Ag(NH3)+] + [Ag(NH3)2+] Концентрации [Ag(NH3)+] и [Ag(NH3)2+] выражаем из констант устойчивости β1 и β2 и подставляем в уравнение материального баланса: [Ag(NH3)+] = β1∙[Ag+] + [NH3] [Ag(NH3)2+] = β2∙[Ag+] + [NH3]2 СAg+ = [Ag+] + β1[Ag+] + [NH3] + β2[Ag+] + [NH3]2 = [Ag+] (1+ β1[NH3] + β2[NH3]2) Определяем [Ag+]:
Находим Чем сильнее α-коэффициент отклоняется от 1, те более прочным является образующийся комплекс.
6. Важной характеристикой реакции комплексообразования является функция образования ( Функция образования (
7. Хелаты – это циклические соединения. К хелатам относятся внутрикомплексные соединения (ВКС). Каждое ВКС является хелатом, но не каждый хелат является ВКС. ВКС – это соединения, в которых ион металла связан с лигандами одновременно двумя типами связи: донорно-акцепторной и валентной. ВКС – это хелат, в котором замыкание цикла сопровождается вытеснением из кислотных функциональных групп одного или нескольких протонов ионом металла. Органическое соединение содержит две группы: солеобразующую и комплексообразующую. Донорно-акцепторная связь образуется за счет комплексообразующей группы. Валентная - за счет солеобразующей группы.
Комплексообразующие и солеобразующие группы должны быть расположены в молекуле органического соединения в орто -положении, чтобы не было стерических затруднений при образовании комплекса.
Устойчивость ВКС Наиболее устойчивыми являются 5и 6-членные циклы 9правило циклов Чугаева). Чем больше число циклов замыкается в ионе металла, тем более устойчивым является ВКС.
Свойства ВКС: а) образуют интенсивно окрашенные соединения: б) обладают высокой прочностью; в) мало растворимы в воде, хорошо растворяются в органических растворителях.
ЛЕКЦИЯ № 4
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 1762; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.44.108 (0.023 с.) |

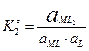

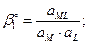

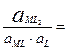



 не зависит от активности компонентов и комплексных частиц, зависит от природы и температуры. Активность комплексных частиц редко известна, поэтому чаще пользуются концентрационной константой образования (βn).
не зависит от активности компонентов и комплексных частиц, зависит от природы и температуры. Активность комплексных частиц редко известна, поэтому чаще пользуются концентрационной константой образования (βn).
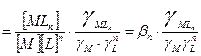
 ).
). [MLn] выражаем из
[MLn] выражаем из  и подставляем
и подставляем
 отсюда
отсюда 


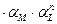




 ).
).





