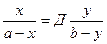Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гравиметрический метод анализа
План: 1. Методы отгонки и осаждения 2. Условия образования кристаллических и аморфных осадков. 3. Причины загрязнения осадка (совместное осаждение, соосаждение, последующее осаждение). 4. Классификация видов соосаждения: адсорбция, окклюзия, образование новых химических соединений, изоморфизм. 5. Пути уменьшения загрязнения осадка. 6. Требования к осаждаемой и гравиметрической формам (самостоятельно). 7. Практические вопросы гравиметрии (самостоятельно): а) определение серы в сульфатах; б) определение Аl и Fe осаждением аммиаком; в) определение Ca Mg при совместном присутствии; г) определение осаждением диметилглиоксимом.
1. Гравиметрия основана на том, что определяемое вещество выделяют в виде малорастворимого соединения (метод осаждения). Методом отгонки определяются те компоненты, которые или летучи или могут превращаться в летучие соединения в результате химической реакции. Методы отгонки делят на прямые и косвенные. К прямым относится определение СO2 в карбонатных породах. Навеску породы растворяют в HCl, CO2 поглощают поглотителем. По увелечению массы поглотителя определяют содержание CO2. Косвенный метод – определение гигроскопической и кристаллизационной воды. В методе осаждения определяемый компонент выделяют в виде осадка, затем его отфильтровывают, промывают, высушивают, взвешивают и по массе осадка рассчитывают содержание определяемого компонента. 2. Образование осадка происходит в две стадии: а) образование зародышевых центров; б) рост первичных кристаллов, их укрупнение и выпадение в осадок. Вторая стадия может протекать двумя различными путями, в зависимости от этого образуется кристаллический или аморфный осадок. I путь II стадии прибавление новой порции осадителя вызывает образование новых центров кристаллизации, затем эти частицы укрупняются и выпадают в осадок. Осадок состоит из большого количества слабосвязанных между собой мелких частиц. II путь IIстадии прибавление новой порции осадителя не вызывает образования новых центров кристаллизации, происходит постепенный рост ранее выделенных зародешевых кристаллов. При этом образуется кристаллический осадок. Важным фактором, определяющим величину частиц кристаллического осадка является фактор относительного пресыщения раствора
Условия образования кристаллических осадков 1) осаждение ведут из разбавленных растворов разбавленным раствором осадителя; 2) осадитель прибавляют медленно; 3) из горячего раствора; 4) при наименьшем значении pH; 5) оставляют на созревание под маточным раствором. Условия образования аморфных осадков
1) из концентрированных растворов ведут осаждение концентрированным раствором осадителя; 2) осадитель прибавляют быстро, что уменьшает вероятность образования коллоидных растворов; 3) из горячего раствора, чтобы ускорить процесс коагуляции; 4) прибавляют коагулятор для предотвращения пептизации осадка; 5) не оставляют на созревание, сразу фильтруют.
3. Осадок может загрязняться посторонними веществами за счет трех причин: а) соосаждение –загрязнение осадка за счет примеси, растворимых в условиях осаждения; б) совместное осаждение – осаждение примесей вместе с основным веществом. Совместное осаждение происходит за счет достижения в растворе произведения растворимости как основного вещества, так и примесей; в) последующее осаждение – вместе с осадком через некоторое время после образования осадка в осадок выпадают посторонние ионы. Например, в растворе имеются ионы Ca2+, Мg2+, осаждают C2O42-, в осадок выпадает CaC2O4, в процессе созревания постепенно выпадает MgC2O4.
Типы соосаждения а) поверхностная адсорбция – концентрирование вещества на поверхности осадка. Причиной адсорбции является нескомпенсированность зарядов ионов на поверхности осадка. Адсорбция подчиняется правилу Панета-Фоянса-Хана. На поверхность осадка в первуочередь из раствора адсорбируются те ионы, которые образуются ионами осадка наименее растворимые или наименее диссоциированные соединения. Величина адсорбции зависит от концентрации адсорбируемого вещества в растворе. Эта зависимость называется изотермой;
б) окклюзия – это вид соосаждения, при котором примеси захватываются растущими кристаллами. Окклюизировнные примеси занимают те места, где имеются в кристаллической решетке дефекты. Окклюзия также подчиняется правилу Панета-Фоянса-Хана.
в) Образование новых химических соединений. Осаждаем Hg2+ с S2-, образуется черный осадок HgS. Если раствор содержит большое количество Cl- ионов, то образуется (HgCl)2S белого цвета. г) Изоморфизм (сокристаллизация). Если размеры кристаллических решеток двух изоаморфных соединений почти одинаковы, один из ионов в кристаллической решетке замещается другим ионом и в результате образуются смешанные кристаллы. Изоморфизм подчиняется закону Хлопина. Если два вещества являются изоморфными, концентрация одного из них мала, то распределение микрокомпонента между раствором и осадком не зависит от соотношения фаз и характеризуется постоянной величиной, называемой коэффициентом распределения. Математическое выражение закона Хлопина:
а –начальная концентрация микрокомпонента в растворе; b- начальная концентрация макрокомпонента в растворе; x – количество микрокомпонента в осадке; y - количество макрокомпонента в осадке; Д – коэффициент распределения Хлопина.
Чем больше Д, тем больше микропримеси переходит в осадок, тем осадок получается более грязным.
5. Способы уменьшения соосаждения: а) соблюдение условий для образования кристаллических и аморфных осадков; б) промывание осадка растворами электролитов; в) переосаждение. Осадок отфильтровывают, промывают, при этом часть примесей остается в растворе. Затем осадок растворяют и повторно осаждают. Переосаждение используют для борьбы окклюидированными примесями. 7. Практические вопросы гравиметрии разбирать по схеме: а) принцип метода; б) растворимость осадка; в) форма осаждения; г) чистота осадка; д) гравиметрическая форма.
ЛЕКЦИЯ 11 ПРОБООТБОР И ПРОБОПОДГОТОВКА
План: 1. Представительность пробы. Способы получения средней пробы твердых, жидких и газообразных веществ. 2. Основные способы перевода пробы в форму, необходимую для анализа: растворение, спекание, сплавление. 3. Особенности разложения органических соединений.
1. Первым этапом любого химического анализа является отбор пробы. Обычно для анализа берут представительную (среднюю) пробу, состав и свойства которой идентичны составу м свойствам всей массы анализируемого вещества. Различают генеральную, лабораторную и анализируемые пробы. Генеральная проба непосредственно отбирается из самого анализируемого объекта (1-50 кг и 0,5-5 т для руд). Из генеральной пробы путем сокращения отбирают лабораторную пробу 9от 25г до 1 кг). При отборе необходимо учитывать агрегатное состояние пробы, неоднородность материала и размер частиц. В жидком и газообразном состоянии проба однородна и отбор пробы не вызывает затруднений. Пробу металлов отбирают путем распиливания, дробления и высверливания. Пробу отбирают из внутренней части куска и с поверхности. Из слитка металла представительную пробу получают распиливая кусок поперек через равномерные промежутки и отбирая «опилки». Можно образец просверлить через равномерные промежутки и собрать стружку.
Отбор пробы твердых веществ вызывает ряд затруднений. При перевозке сыпучие вещества расслаиваются, под действием воздуха и влаги изменяют цвет. Поэтому пробу отбирают из разных участков материала. Их объединяют и отбирают среднюю пробу. Оптимальную массу пробы определяют по формуле: θ=kd2, θ –масса пробы, к – эмпирический коэффициент, d – наибольший диаметр частиц. После отбора пробы твердого вещества, его измельчают, просеивают, перемешивают и сокращают. Сокращение проводят методом квартования, суть которого заключается в том, что пробу высыпают на бумагу, собирают в виде конуса, конус превращают в окружность, затем ее делят на 4 ровные части и отбрасывают 2 противоположных сектора. Эту операцию повторяют до получения пробы массой до 150-200 г. Среднюю пробу помещают либо в закрытые металлические и стеклянные емкости, или в полиэтиленовые мешочки. Пробу снабжают этикеткой с указанием названия пробы ее происхождения, ставят дату отбора и цель анализа. Проба д.б. достаточной для 2-3 параллельных определений. Пробу из потока газа отбирают методом продольных струй и поперечных сечений. Метод продольных струй применяют, когда состав газа вдоль потока не меняется (поток делят на ряд струй и пробу отбирают через одну струю). Если состав газа не меняется, используют метод поперечных сечений, пробу берут на определенных расстояниях 2. Следующим этапом химического анализа является подготовка пробы к анализу. Она включает высушивание пробы, разложение пробы и удаление мешающих компонентов. Для удаления воды из пробы твердых веществ, пробу высушивают до постоянной массы по стандартным методикам либо на воздух, либо в сушильном шкафу при температуре 105-120°С в течение 1-2 г. Для растворения твердого вещества используют воду. В ней растворяют соли щелочных металлов, алюминия, магния, спирты и некоторые другие соединения. Обычно для растворения используют минеральные кислоты. HClконц растворяет оксиды многих металлов. Горячая HNO3 конц растворяет все металлы, за исключением Cr и Al. H2SO4 конц разлагает органические соединения. HF используют для разложения силикатных пород, минералов. Для удаления мешающих компонентов используют маскировку, экстракцию, концентрирование и осаждение. При разложении силикатов, горных пород, сплавов железа жидкие растворители не подходят. В этом случае используют сплавление с соответствующим плавнем.
При сплавлении необходимы высокие температуры (300-1000°С). Сплавление имеет ряд недостатков: 1) происходит загрязнение анализируемого материала; 2) высокие температуры увеличивают опасность потерь за счет летучести. Выбор плавня зависит от анализируемого материала. Силикаты, фосфаты, сульфаты сплавляют с Na2CO3 в платиновых тиглях. При обработке металлические компоненты превращаются в растворимые в кислотах карбонаты и оксиды, неметаллические компоненты превращаются в растворимые соли натрия. К щелочным плавням относятся кроме Na2CO3, NaOH, бораты щелочных металлов и их смеси. К кислым плавням относятся K2Cr2O7, KHSO4, B2O3. Сплавление с K2Cr2O7 проводят в фарфоровых или кварцевых тиглях при температуре 400°С. В плаве образуются сульфаты, бораты соответствующих металлов. K2Cr2O7 → K2SO4 + SO2 2KHSO4 → K2Cr2O7 + H2O К окислительным плавням относятся щелочные плавни (Na2CO3, Na2B4O7, NaOH) с добавкой KNO3, KClO3, NaNO3. Иногда используют Na2O2 для сплавления минералов содержащих Cr, Sn, Zr, сульфидов, сплавов Fe, Ni, Cr, Mo, W, Li, Pt. При разложении силикатов с целью определения щелочных металлов используют спекание. Пробу спекают со смесью CaCO3 и NH4Cl в соотношении 8:1. При нагревании образуется: NH4Cl → NH3 +HCl
CaCO3 =CaO + CO2 (1000-1100°C) Смесь CaO и CaCl2 взаимодействует с пробой с образованием CaSiO3 + NaCl. При обработке расплавленной массы водой получают водный раствор хлоридов щелочных металлов. 3. Разложение органических соединений проводят методами мокрого озоления и термического разложения. При мокром озолении применяют H2SO4 и HClO4. Разложение органических соединений проводят в трубках. Метод Дюма (самостоятельно).
ЛЕКЦИЯ № 12
|
||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 1938; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.31.209 (0.02 с.) |
 . Для получения крупного кристаллического осадка
. Для получения крупного кристаллического осадка