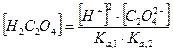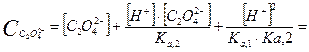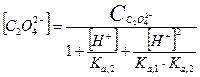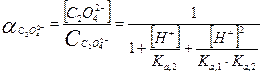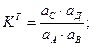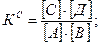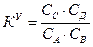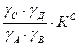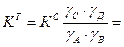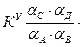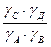Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химическое равновесие в реальных системахСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
План: 1. Идеальные и реальные системы. 2. Электростатическое взаимодействие: 3. Химическое взаимодействие: а) конкурирующие реакции; б) равновесная и аналитическая концентрации; в) молярная доля компонента и коэффициент конкурирующей реакции; 4. Термодинамическая, концентрационная и условная константы равновесия и связь между ними.
1. Различают идеальную и реальную системы. В идеальной системе ионы и молекулы рассматриваются изолированно, они не испытывают воздействий со стороны растворителя и других- компонентов системы. К идеальным системам можно отнести бесконечно разбавленные растворы. 2. В реальных системах имеет место межионное взаимодействие электростатического характера. В результате около каждого иона образуется ионная атмосфера, приводящая к торможению движения иона. Поэтому концентрация вещества без учета электростатического взаимодействия не может точно охарактеризовать свойство и поведение электролита. Для учета электростатического взаимодействия концентрацию вещества заменяют активностью. Активность - это эффективная концентрация иона, соответственно которой он реагирует в химических реакциях. Активность такую же размерность, что и концентрация. Активность связана с концентрацией через коэффициент активности γ: а = γּ[]. γ является мерой действия межионных сил в растворе и характеризует отклонение реальной системы от идеальной за счет электростатического взаимодействия ионов. Суммарное действие сил выражается ионной силой I раствора. I = ½(C1Z12 + C2I22 + …+ CnZn2). I зависит от концентрации, заряда ионов, но не зависит от природы иона. Ионная сила характеризует напряженность электрического поля, действующего на ионы в растворе. Связь между I и γ выражается уравнением Дебая-Хюккеля:
Какие же значения может принимать γ? В идеальных растворах (разбавленные растворы слабых электролитов и бесконечно разбавленные растворы сильных- электролитов) межионное взаимодействие мало, γ <1 и a=[ ]. При увеличении концентрации электролита I раствора увеличивается и γ <1, а < [ ]. В сильно концентрированных растворах γ возрастает и становится γ > 1. В концентрированных растворах происходит дегидратация ионов. Из-за того, что ион легче движется без ионной атмосферы, вероятность столкновения ионов увеличивается, следовательно, γ возрастает. При высоких концентрациях γ зависит от природы иона, при невысоких- концентрациях γ зависит от заряда иона и I. 3. В растворе вещество может вступать не только в электростатическое, но и в химическое взаимодействие. Когда химическое взаимодействие велико, обычно электростатическим взаимодействием пренебрегают. При протекании химического взаимодействия наряду с основной реакцией могут идти конкурирующие (побочные) реакции протонирования, осадкообразования, окисления-восстановления. В результате протекания конкурирующих- реакций вещество распределяется между разными химическими формами. Концентрация отдельной формы в момент равновесия называют равновесной. Сумму концентраций всех равновесных форм называют общей или аналитической концентрацией. Уравнение, связывающее равновесную концентрацию всех- форм с общей концентрацией называют уравнением материального баланса. В растворе соблюдается условие электронейтральности: сумма концентраций положительных и отрицательных зарядов равна нулю. Для характеристики химического взаимодействия используют молярную долю (α-коэффициент), которая представляет собой отношение равновесной концентрации вещества к его общей концентрации: α -коэффициент характеризует глубину протекания конкурирующей реакции, может принимать значения α<1 и α=1. Иногда пользуются коэффициентом конкурирующей реакции (α'): При растворении Na2C2O4 в воде наряду с образованием ионов Na+ и C2O42- возможно образование ионов HC2O4- и H2C2O4. Запишем уравнение материального баланса: Равновесные концентрации [HC2O4-] и [H2C2O4] выражаем из соответствующих констант равновесий:
Концентрации [HC2O4-] и [H2C2O4] подставляем в уравнение материального баланса:
Выразим Вычислим 4. В большинстве случаев химические реакции обратимы и подчиняются ЗДМ. A + B ↔C+ D Для этой реакции запишем термодинамические (КТ), концентрационные (КС) и условные (КУ) константы равновесия.
В идеальной системе отсутствует и электростатическое и химическое взаимодействие, поэтому γ=1, α =1 и все константы равны: КТ= КС= КУ. Рассмотрим случай, когда в реальной системе протекает только электростатическое взаимодействие. Равновесие в системе характеризуется двумя константами КТ и КС. Связь между КТ и КС:
KT не является универсальной постоянной, поскольку она зависит от природы реагирующих веществ, температуры и давления. KС зависит от природы реагирующих веществ, температуры, давления и ионной силы раствора. KС постоянна в том случае, если I =0 или I = const. Когда в системе протекает и электростатическое и химическое взаимодействие (α<1 и γ<1), равновесие в системе характеризуется тремя константами KТ, KС, KУ. Связь между KС и KУ: KУ зависит от природы реагирующих веществ, температуры. I, α. KУ является постоянной величиной, если I =0 или I = const, α=1. Связь между KТ, KС, KУ: Одна и та же система может иметь одну KТ и несколько KС и множество KУ.
ЛЕКЦИЯ № 3
|
||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 3322; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

 (предельное уравнение Дебая-Хюккеля). Это уравнение выполняется при I ≤ 0,01. Когда I ≤ 0,01 используется расширенное уравнение Дебая-Хюккеля:
(предельное уравнение Дебая-Хюккеля). Это уравнение выполняется при I ≤ 0,01. Когда I ≤ 0,01 используется расширенное уравнение Дебая-Хюккеля:  .
.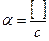 .
. .
.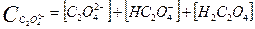 .
.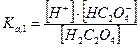 (1);
(1); 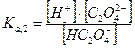 (2)
(2)