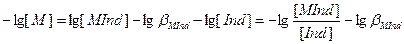Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Интервал перехода окраски индикатораСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Запишем схему образования комплекса. M + Ind ↔ Mind
pM=lgβMind ± 1 Металлиндикатор является многоосновной кислотой, в зависимости от pH может существовать в виде протонированной и непротонированной формах. Поэтому вместо комплекса MInd может образовываться комплекс MHiInd. Тогда используют условную константу β΄. pM = lgβ΄MInd ± 1
5. I. Прямое титрование –непосредственное титрование определяемого вещества с комплексоном. Прямым титрованием определяют около 30 ионов металла. II. а) Обратное титрование используют, когда реакция комплексообразования с ЭДТА протекает медленно. Например, Al3+, Hg2+, Cr3+, Co3+ с ЭДТА образуют комплексы очень медленно, т.е. комплексы инертны. К раствору, содержащему эти ионы, добавляют точно измеренный избыток титранта ЭДТА, нагревают до кипения в течение 10-15 мин. Затем после охлаждения избыток ЭДТА оттитровывают стандартным раствором Fe (III) в присутствии индикатора с сульфосалициловой кислоты. Fe (III) с сульфосалициловой кислотой дает красное окрашивание. б) обратное титрование используют, если нет подходящего индикатора для фиксирования ТЭ. Например, таллий, германий, сурьма (V) с комплексоном образуют устойчивые соединения, но подобрать индикатор для фиксирования ТЭ не удается. Избыток комплексона оттитровывают растворами соли Zn, Mg, Cu с ЭХЧТ. в) обратное титрование используют для определения ионов металла, находящегося в виде осадка с анионом. Например, определение Pb в сульфатах, Mg в фосфатах к осадку прибавляют избыток комплексона, осадок растворяется, т.к. образуется комплексное соединение с анионами металла, избыток комплексона оттитровывают солью Mg или Zn в присутствии ЭХЧТ.
III. Вытиснительное титрование Большинство катионов образуют с комплексоном более устойчивые комплексные соединения, чем комплекс Mg с комплексоном. Если к раствору исследуемого катиона добавить комплекс Mg с комплексоном, то происходит вытеснение магния в эквивалентном количестве. Me + MgЭДТА = МеЭДТА + Mg2+ Mg2+ оттитровывают с ЭДТА в присутствии ЭХЧТ. Количество вытесненного Mg эквивалентно количеству определяемого иона металла.
IV. Косвенное титрование используют для определения анионов (S-2, SO42-, PO43-). Анионы с ЭДТА не реагируют. Анионы осаждают точно измеренным избыточным количеством осадителя. Избыток ионов металлов не осадившихся определяемым анионом, титруют раствором ЭДТА в присутствии соответствующего индикатора. SO42-+ Ba2+изб = BaSO4↓ + Ba2+ост Ba2+ + ЭДТА = BaЭДТА Индикатор – метилтимоловый синий.
5. Способы повышения селективности комплексонометрического титрования а) создание определенного значения pH, при котором ЭДТА и индикатор реагируют только с одним ионом, а с другими ионами не взаимодействуют; б) маскировка мешающих ионов путем комплексообразования. При определении ионов Ca2+ с мурексидом ионы Fe3+, Al3+, Mn2+ маскируют триэтаноламином; в) маскировка путем изменения степени окисления определяемого или мешающего элемента.
6. Пример определения Ca и Mg при совместном присутствии 1. сначала определяют общее содержание Ca и Mg при pH≈10 используя аммонийный буфер в присутствии ЭХЧТ. 2. Затем в другой пробе анализируемого раствора определяют кальций. К раствору прибавляют щелочь для осаждения Mg в виде Mg(OH)2. Катионы Ca2+ остаются в растворе. Их определяют титрованием стандартным раствором ЭДТА в присутствии индикатора мурексида до перехода розовой окраски в сине-фиолетовую. 3. Mg определяют по разности.
|
||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 570; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.171.100 (0.009 с.) |