
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Индикаторные погрешности титрованияСодержание книги
Поиск на нашем сайте
1. Водородная и гидроксильная погрешности. 2. Кислотная и щелочная погрешности. 3. Погрешности титрования многоосновных кислот и многокислотных оснований. 4. Погрешности метода окислительно-восстановительного титрования. 5. Другие источники погрешностей кислотно-основного титрования.
1. При титровании всегда возникают определенные погрешности. Индикаторные погрешности связаны с применяемым индикатором. В методе кислотно0основного титрования они возникают в связи с тем, что значение pH в ТЭ не совпадает с pT индикатора и раствор оказывается недотитрованным или перетитрованным. По методу расчета индикаторные погрешности можно разделить на две группы: водородная и гидроксильная, кислотная и щелочная. Водородная и гидроксильная погрешности возникают за счет того, что в титруемом растворе в момент окончания титрования присутствует избыток сильной кислоты, т.е. H+-ионов или избыток сильного основания, т.е. OH--ионов. Выведем формулу для расчета водородной погрешности Пусть для титрования взято V1 мл раствора сильной кислоты с молярной концентрацией С. Исходное количество кислоты в растворе с объемом V1 равно Отсюда [H+]=10-PT –концентрация ионов водорода, оставшаяся неоттитрованной. Количество ионов H+ в момент окончания титрования в объеме V2 составляет водородную погрешность
Отсюда определяем ПТн
В момент окончания титрования объем изомолярных растворов удваивается: V2=2V1 С учетом этого ПТн имеем вид:
Пример 1. Рассчитать погрешность при титровании 0,1М раствора HCl с 0,1 М раствором NaOH, если использовать индикатор метиловый оранжевый с pT=4. ТЭ при титровании сильной кислоты сильным основанием достигается при pH=7, титрование заканчивается при pH=4, в избытке остается сильная кислота, которая вызывает H+ погрешность.
Раствор недотитрован, поэтому знак погрешности «-».
Гидроксильная погрешность выводится аналогичным образом. Выводы 1. Водородная погрешность возникает при титровании сильной кислоты сильным основанием и, наоборот, если использовать индикаторы с pT<7, а также при титровании слабого основания сильной кислотой, если, использовать индикаторы с pT<5. 2. Гидроксильная погрешность возникает при титровании сильного основания сильной кислотой и, наоборот, если использовать индикаторы с pT>7, а также при титровании слабой кислоты сильным основанием, если использовать индикаторы с pT>7
2. Кислотная и щелочная погрешности вызваны наличием в титруемом растворе в момент окончания титрования избытка слабой кислоты или слабого основания. Методика расчета кислотной погрешности отличается от методики расчета H+OH- погрешности. В общем случае погрешность титрования рассчитывается как отношение концентрации неоттитрованной части раствора к общей его концентрации. Для упрощения расчетов вместо общей концентрации раствора берут концентрацию оттитрованной части раствора.
Кислотная погрешность определяется следующим образом:
Щелочная погрешность рассчитывается аналогично.
Пример 2. Рассчитать погрешность титрования 0,1М раствора CH3COOH с 0,1 М раствором NaOH с метиловым оранжевым. pka =4.76, pT=4, pHТЭ ≈9
5.75 – это отношение неоттитрованной части к оттитрованной части. Далее это отношение переводят в %. Если большие погрешности, то сразу нельзя умножать на 100%. Всего 6,75 частей – 100% 5,75 -ПТНА
Индикатор выбран неправильно. Выводы 1.Кислотная погрешность возникает при титровании слабой кислоты сильным основанием, если использовать индикатор с pT<9. 2. Щелочная погрешность возникает при титровании слабого основания сильной кислотой, если использовать индикатор с pT>5.
3. Погрешности титрования многоосновных кислот рассчитываются по типу кислотных погрешностей, но с учетом наблюдаемых ТЭ. Например, титруют H3PO4 с NaOH H3PO4 + NaOH = NaH2PO4 + H2O pHТЭ =4,68. Индикатор – метиловый оранжевый, раствор недотитрован.
1,0142 - 100% 0,0142 - ПТ1 ПТ1= -1,40% Во II ТЭ pH=9,75, используем индикатор –фенолфталеин, у которого pT=9, р-р будет недотитрован.
1,0162 - 100% 0,0162 - ПТ2 ПТ2= -1,59%
Погрешности при титровании многокислотных оснований Na2CO3 + HCl =NaHCO3 + NaCl pHТЭ =8.34 NaHCO3 +HCl = H2CO3 +NaCl pHТЭ=3.68 Первую ТЭ, фиксируем фенолфталеином. В I ТЭ раствор недотитрован
1,0479 - 100% 0,0479 – ПТ1 ПТ1 = -4,57% Вторую Тэ фиксируем с метиловым оранжевым, у которого pT=4. Во II ТЭ раствор недотитрован.
1,0447 - 100% 0,00447 – ПТ2 ПТ2 = -0,445% Во II ТЭ погрешность титрования мала.
4. Индикаторные погрешности в методе окислительно-восстановительного титрования возникают за счет несовпадения стандартного потенциала индикатора с потенциалом раствора в ТЭ. EoInd = EТЭ EoInd =
Если титруют восстановитель, то [Ox] – концентрация оттитрованного восстановителя, [Red] – концентрация неоттитрованного восстановителя. Когда EoInd < EТЭ, возникает отрицательная погрешность, которую рассчитывают по системе определяемого вещества, если EoInd > EТЭ возникает положительная погрешность, которую рассчитывают по системе титранта.
Пример 3. рассчитать погрешность титрования соли Fe2+ раствором K2Cr2O7 с дифениламином в присутствии H3PO4. EoInd =0,76 В, ЕТЭ = 1,23 В.
Lgx = 2.71 X=102.71 = 513
513 ─ 100% 1 ─ ПТ ПТ =-0,19 Индикатор вполне пригоден.
5. Индикаторные погрешности, которые не подвергаются к расчету, делятся на температурные, солевые, спиртовые, белковые. Температурные погрешности связаны с изменением температуры в растворе. С повышением температуры увеличивается kw и интервал перехода индикатора смещается в кислую область.
Солевая погрешность обусловлена присутствием в растворе посторонних солей, изменяющих ионную силу раствора. С увеличением ионной силы раствора увеличивается kдис. Индикатора. Интервал перехода индикаторов –кислот смещается в кислую область, индикаторов-оснований –в щелочную область. Спиртовая погрешность возникает за счет присутствия в растворе органических растворителей – спирта, ацетона, которые обладают низкой эиэлектрической проницаемостью, чем вода. Интервал перехода индикатора –кислот смещается в щелочную область, индикатора-оснований – в кислую область. Белковая погрешность связана с присутствием частиц, которые взаимодействуют с индикаторами. Индикатор адсорбируется на них. ЛЕКЦИЯ № 17
ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ
План: 1. Аргентометрическое титрование а) кривые титрования; б) методы Мора, Фольгарда, Фаянса. 2. Меркурометрическое титрование
1. К осадительному титрованию относятся меркурометрия и аргентометрия. В аргентометрии титрантом является AgNO3, первичным стандартом –х.ч NaCl. Определяют галогенид, тиоциант ионы. ТЭ характеризуется прекращением образования осадка NaCl + AgNO3 = AgCl↓ + NaNO3. В ходе титрования меняются концентрации Cl- -ионов и Ag+. В растворе всегда будут ионы Ag+ и Cl- за счет частичной растворимости осадка. При построении кривой титрования по оси ординат откладывают pCl или pAg. Выводы по кривой титрования 1. Скачок на КТ зависит от произведения растворимости образующего осадка. Чем меньше kso, тем больше скачок на КТ. Скачок на КТ становится очень маленьким и исчезает, если kso > 10-10. 2. Скачок зависит от концентрации титруемых растворов. Чем больше исходная концентрация, тем больше скачок. 3. Выбор индикатора не связан с кривой титрования.
В методе Мора титрование проводится в интервале pH 6,5-10,3, т.к. при pH<6.5 Ag2CrO4 растворяется, а при pH<10,3 начинает осаждаться AgOH, который превращается в коричневый Ag2O. Методом Мора определяют Cl-, Br- ионы. Иодид ион не определяется, т.к. осадок AgI адсорбирует хромат-ионы CrO42-, что затрудняет установление ТЭ. Метод Фольгарда. Используют обратное титрование. В качестве индикатора используют соль Fe (III). Титрование проводят в кислой среде для предотвращения гидролиза Fe (III). Сl- осаждают избыточным количеством AgNO3, Оставшиеся ионы Ag+ титруют KSCN в присутствии FeCl3. Появляется красный цвет в ТЭ, который исчезает через 10 с.
2. В основе меркурометрического метода лежит реакция: Hg2(NO3)2 + NaCl = Hg2Cl2 + 2NaNO3, В качестве титранта используют Hg2(NO3)2, первичны стандартом является -х.ч. NaCl. ТЭ характеризуется прекращением осадка Hg2Cl2. После ТЭ появляется лишняя капля Hg2(NO3)2, т.е. ионы Hg22+ с индикатором – дифенилкарбазоном образуют сине-феолетовую окраску. Титрование проводят в кислой среде.
Тема: Комплексонометрическое титрование План: 1. Неорганические титранты в комплексонометрии. Цианометрия и меркуриметрия. 2. органические комплексообразователи. 3. Комплексонометрическое титрование. 4. Металлиндикаторы. 5. Способы титрования. 6. Селективность комплексонометрического титрования и способы ее повышения. 7. Пример практического применения комплексономтерического титрования. Определение Ca и Mg при совместном присутствии.
1. В основе комплексонометрического титрования лежат реакции комплексообразования. В качестве неорганического титранта использовали KCN со многими тяжелыи металлами (Ag, Ni, Co, Cu) образует прочные комплексы. Поэтому достаточно точно можно зафиксировать ТЭ. Метод запрещен ввиду того, что KCN – яд, при титровании в кислой среде выделяется HCN, пары которого ядовиты. В основе меркуриметрии лежит реакция: Hg2(NO3)2 + NaCl = Hg2Cl2 + 2NaNO3 Первичный стандарт –х.ч. NaCl. Образуется сумма, которая является слабым электролитом. Достижение ТЭ характеризуется прекращением образования Hg2Cl2 ТЭ фиксируют дифенилкарбазидом. 2. К орагническим комплексообразователям относятся комплексы. Это органические соединения, в молекулах которых содержатся и основные, и кислотные центры, и образуют прочные ВКС. К простейшим комплексам относится иминодиуксусная кислота, нитрил триуксусная кислота этилен диаминтетрауксусная кислота Двунатриевая соль этилендиаминтетрауксусной кислоты
Из комплексонов наибольшее значение имеет комплексон III, который представляет собой слабую четырехосновную органическую кислоту. Комплексон III лучше растворяется в H2O, чем комплексон II. Стандартизацию комплексона III проводят по раствору цинка, полученного растворением х.ч. Zn в HCl. Для стандартизации используют х.ч. CaCO3 или фиксанал MgSO4. Комплексон III примерно с 20 катионами образует прочные комплексные соединения. Большинство катионов образуют лабильные комплексы. Некоторые катионы (Al3+, Cr3+) образуют инертные комплексы. Комплексонаты неокрашенных ионов металла – бесцветные, окрашенных ионов Me –имеют еще более интенсивную окраску.
Щелочные металлы с комплексоном не реагируют. Устойчивость комплексонатов металлов зависит от pH раствора. Комплексонаты щелочноземельных металлов устойчивы в щелочных и слабо-кислых средах. Комплексонаты Fe3+ и Al3+ устойчивы в кислых средах (pH≈2-5). Комплексонаты четырехвалентных металлов устойчивы в сильнокислых средах (pH<1) (Th, Zr). 3. Комплексонометрическое титрование основано на связывании определяемого иона металла в прочное комплексное соединение. ТЭ характеризуется полным исчезновением свободных ионов металла из раствора за счет образования комплексонатов. Устойчивость этих комплексонатов настолько велика, что связанный в комплексонат ион металла нельзя обнаружить ни с одним реагентом.
Лекция № 18
Выводы по кривой титрования 1. Скачок на КТ зависит от константы образования комплексоната металла. Чем больше константа образования комплексоната металла, тем больше скачок на КТ. Если константа образования меньше чем 107, скачок pMe практически исчезает и титрование становится невозможным. 2. Скачок на КТ зависит от концентрации титруемых растворов. Чем больше концентрация титруемых растворов, тем больше скачок на КТ. 3. Скачок на КТ зависит от pH раствора, при котором ведется титрование. Выбирают такое значение pH, при котором образующийся комплексонат был бы устойчивым. Минимальное значение pH, при котором Ca2+ можно определить, равно 8. При pH≈6 скачок на КТ практически исчезает. 4. величина скачка на КТ зависит от α-коэффициента. Чем больше αMe и
Для фиксирования ТЭ в комплексонометрии применяют металлиндикаторы, которые реагируют на изменение концентрации иона металла. Металлоиндикаторы – это красители, образующие окрашенные комплексы с ионами металла в определенных значениях pMe. К металлоиндикаторам предъявляются ряд требований: а) окраски комплексоната металла и индикатора должны контрастно отличаться друг от друга; б) комплекс металла с индикатором д.б. менее устойчивым, чем комплекс металла с комплексоном. Разница в устойчивостях комплекса должна составить примерно 2-4 порядка βMY/βMInd ≤ 104; в) индикатор должен взаимодействовать с ионом металла более чувствительно и избирательно. Рассмотрим индикатор ЭХЧТ, который представляет собой трехосновную слабую кислоту:
H2Ind- ↔ HInd2- ↔ Ind3- pH=0-6 6.3-11.2 >11.2
а) К раствору, содержащему ионы металла до начала прибавления титранта, добавляют индикатор ЭХЧТ, при этом часть ионов металла связывается в комплекс с ЭХЧТ, имеющий малиновую окраску, часть ионов остается несвязанной. Me +Ind ↔ MeInd б) Далее к этому раствору добавляют титрант-комплексон III, происходит реакция: Me + ЭДТА = МеЭДТА, изменение окраски пока не происходит. в) продолжаем прибавлять титрант, когда уже ионы металла связались в комплекс. Вблизи ТЭ при прибавлении титранта происходит разрушение комплекса металла с индикатором. И в ТЭ мы наблюдаем появление в растворе свободного индикатора. Me + ЭДТА = МеЭДТА + Ind
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 6888; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.170.67 (0.012 с.) |

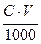 . Это количество кислоты примем за 100 %. Если использовать индикатор, у которого pT<pHТЭ, титрование заканчивается раньше ТЭ (кислота остается недотитрованной). Какое количество кислоты осталось неоттитрованным. Титрование заканчивают при pH=pT.
. Это количество кислоты примем за 100 %. Если использовать индикатор, у которого pT<pHТЭ, титрование заканчивается раньше ТЭ (кислота остается недотитрованной). Какое количество кислоты осталось неоттитрованным. Титрование заканчивают при pH=pT. - ПТн.
- ПТн.

 .
.

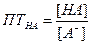







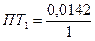






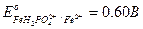



 , тем больше скачок.
, тем больше скачок.




