
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: фиксирование ТЭ в методе кислотно-основного титрованияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
План: 1. Интервал перехода окраски индикатора и показатель титрования pT. 2. Теория кислотно-основных индикаторов. 3. Выбор индикаторов при титровании
В методе кислотно-основного титрования ТЭ характеризуется достижением определенного значения pH раствора. Для фиксирования ТЭ используют кислотно-основные индикаторы (КОИ). КОИ представляют собой органические кислоты, у которых протонированные и непротонированные формы имеют различную окраску. HInd ↔ H+ +Ind-
При каждом изменении pH раствора должны наблюдать изменение окраски индикатора. Не каждое изменение окраски индикатора человеческий глаз почувствует. Человеческий глаз способен улавливать переход окраски при соотношении различно окрашенных форм 10:1. Тогда pH=pKинд ± 1. Интервал перехода КОИ – это область значений pH, внутри которой происходит заметное изменение окраски индикатора. Титрование мы заканчиваем при определенном значении pH (при показателе титрования pT). Показатель титрования –это значение pH внутри интервала перехода, при котором происходит наиболее резкое изменение окраски индикатора. pT обычно лежит в середине интервала перехода окраски индикатора и ближе к pKинд.
2.Существует несколько теорий кислотно-основного индикаторов Первая теория –ионная теория индикаторов Остфальда. Согласно этой теории КОИ –это слабые органические кислоты и основания, у которых протонированные и непротонированные формы имеют различную окраску. Hind ↔ H+ +Ind-
При добавлении H+ OH- ионов происходит смещение равновесия диссоциации индикатора в сторону образования протонированной и непротонированной форм, что сопровождается изменением окраски индикатора. Ионная теория обладает рядом недостатков: а) она не ввязывает окраску индикаторов с их строением; б) согласно этой теории переход одной формы индикатора в другую должен происходить как ионная реакция. Ионные реакции протекают быстро, мгновенно. Индикатор меняет свою окраску постепенно. Вторая теория – хромофорная теория Ганча, которая основана на теории цветности Витте. Согласно этой теории, окраска органических соединений обусловлена наличием хромофора Кроме хромофора окрашенное органическое соединение должна содержать группы атомов, усиливающих окраску индикатора. Согласно хромофорной теории КОИ – это органические вещества, которые способны существовать по крайней мере в виде двух таутамерных форм, и хотя бы один из таутомеров должен содержать хромофор.
Рассмотрим фенолфталеин. Это одноцветный индикатор, в кислой среде –бесцветный, в щелочной – малиновый.
Изменение окраски индикатора происходит за счет внутримолекулярной перегруппировки, приводящая к таутомерному превращению. Внутримолекулярная перегруппировка происходит не мгновенно, а постепенно. Хромофорная теория не объясняет, почему таутомерные превращения и изменение окраски индикатора происходит при изменении pH растовра. Третья теория – хромофорно-ионная теория Кальтгоффа. Согласно этой теории, КОИ –это органические соединения, способные существовать по крайней мере в виде двух таутомерных форм, хотя бы одна из таутомерных форм должна быть слабой кислотой или слабым основанием. Изменение окраски индикатора происходит за счет внутримолекулярной перегруппировки и диссоциации индикатора.
При добавлении H+ равновесие смещается влево –в сторону бесцветной формы. При добавлении OH- -в сторону окрашенной формы. Хромофорная теория не могла объяснить периодичность изменения окраски индикатора. Фенолфталеин –в кислой среде бесцветный, в щелочной –малиновый, в сильно-щелочной –бесцветный, в сильно-кислой –оранжевый. Четвертая теория – координационно-ионная теория Вицингера и Дильтея. Согласно этой теории, КОИ – это органические соединения, которые содержат в молекуле хромофор, представляющий собой координационно-ненасыщенный атом, находящийся в ионоидном состоянии.
В щелочной среде фенолфталеин имеет малиновую окраску за счет образования координационно-ненасыщенного атома углерода. В сильно-щелочной среде углерод насыщается с OH- -группой, образуется карбинальное основание и окраска исчезает. В сильно-кислой среде
Последняя теория является спорной.
3. В методе кислотно-основного титрования индикатор выбирают по кривой титрования. Индикатор выбирают так, чтобы интервал перехода окраски полностью или хотя бы частично входил в скачок титрования. Необходимо, чтобы pT индикатора входил в скачок титрования.
При титровании 0,1М раствора сильной кислоты 0,1 М раствором сильного основания скачок составляет 6 единиц. Для титрования можно использовать любые индикаторы, интервалы перехода которых лежат от 4 до 10. В данном случае подходят метиловый оранжевый, метиловый красный, фенолфталеин. При титровании слабой кислоты сильным основанием скачок pH лежит в щелочной области (~9). Для фиксирования ТЭ используют индикаторы, которые меняют свою окраску в щелочной области. При титровании слабого основания сильной кислотой скачой лежит в кислой области (~5,3). Используют индикаторы, которые меняют свою окраску в кислой области. При титровании H3PO4 I ТЭ фиксируют метиловым оранжевым, II ТЭ фиксирую фенолфталеином. Титровать H3PO4 до III ТЭ невозможно ни с одним из индикаторов. При титровании Na2CO3 c HCl первую ТЭ фиксируют фенолфталеином, вторую ТЭ - метиловым оранжевым. Тема: Окислительно-восстановительное титрование План: 1. Кривые титрования 2. Индикаторы методов окисления-восстановления а) безиндикаторное титрование; б) специфические индикаторы; в) Редокс-индикаторы 3.Интервал перехода редокс-индикатора. 4. Выбор индикатора.
1. Сущность метода заключается в том, что при изменении соотношения концентраций окисленной и восстановленной форм в процессе титрования меняется потенциал системы. Пусть определение вещество будет восстановителем, а титрант – окислителем. aRed1 + вOX2 ↔ aOX1+ вRed2 В любой из моментов титрования раствор содержит две окислительно-восстановительные пары: OX1׀Red1 OX2׀Red2. Удобнее рассчитывать потенциал до ТЭ по системе вещества, а после ТЭ –по системе титранта. до ТЭ после ТЭ в ТЭ
(а+в)EТЭ = aE1o + вE2o
|
||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-25; просмотров: 880; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.185.143 (0.009 с.) |




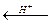








 EТЭ
EТЭ



 , если а=в
, если а=в



