Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биохимия в решении проблем лечения и диагностики заболеваний.Содержание книги
Похожие статьи вашей тематики
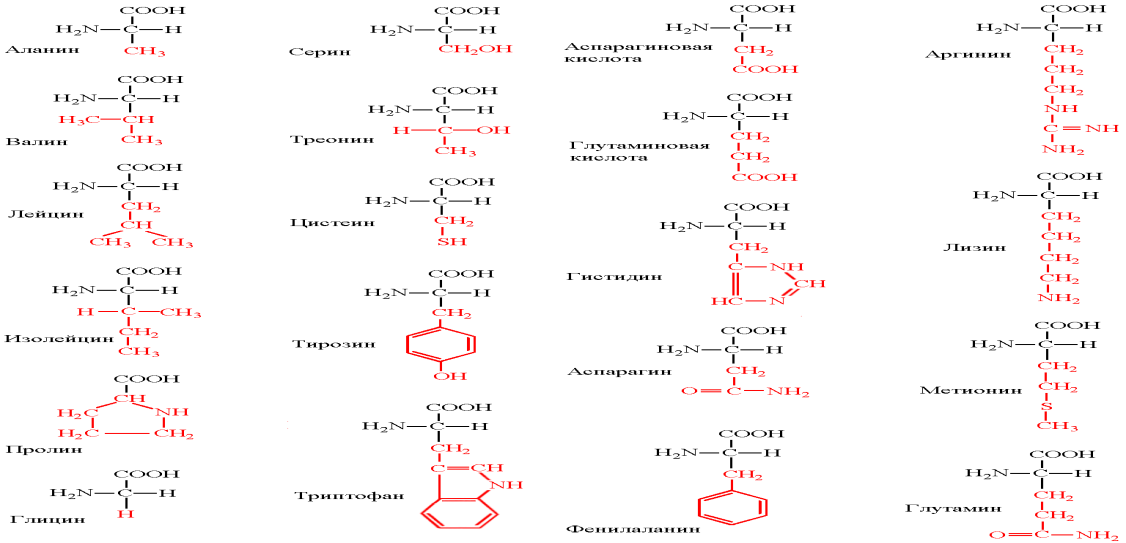
Поиск на нашем сайте Билет 1. Биохимия в решении проблем лечения и диагностики заболеваний. Биохимия — это наука, занимающаяся изучением различных молекул, химических реакций и процессов, протекающих в живых клетках и организмах. Основательное знание биохимии совершенно необходимо для успешного развития двух главных направлений биомедицинских наук: 1) решение проблем сохранения здоровья человека; 2) выяснение причин различных болезней и изыскание путей их эффективного лечения. Все болезни представляют собой проявление каких-то изменений в свойствах молекул и нарушений хода химических реакций и процессов. Возможности биохимии в отношении предупреждения и лечения болезней кратко проиллюстрированы на 2 примерах: 1. Хорошо известно, что для поддержания своего здоровья человек должен получать определенные сложные органические соединения—витамины. В организме витамины превращаются в более сложные молекулы (коферменты), которые играют ключевую роль во многих протекающих в клетках реакциях. Недостаток в диете какого-либо из витаминов может привести к развитию различных заболеваний, например цинги при недостатке витамина С или рахита при недостатке витамина D. Выяснение ключевой роли витаминов или их биологически активных производных стало одной из главных задач, которые решали биохимики и диетологи с начала нынешнего столетия. 2. Патологическое состояние, известное под названием фенилкетонурия (ФКУ), в отсутствие лечения может привести к тяжелой форме умственной отсталости. Биохимическая природа ФКУ известна уже около 30 лет: заболевание обусловлено недостатком или полным отсутствием активности фермента, который катализирует превращение аминокислоты фенилаланина в другую аминокислоту, тирозин. Недостаточная активность этого фермента приводит к тому, что в тканях накапливается избыток фенилаланина и некоторых его метаболитов, в частности кетонов, что неблагоприятно сказывается на развитии центральной нервной системы. После того как были выяснены биохимические основы ФКУ, удалось найти рациональный способ лечения: больным детям назначают диету с пониженным содержанием фенилаланина. Массовое обследование новорожденных на ФКУ позволяет в случае надобности начать лечение незамедлительно. Аминокислотный состав белковых молекул. Основными частями и структурными компонентами белковой молекулы являются аминокислоты. В состав пищевых продуктов входит 20 аминокислот, из них 8 не синтезируются в организме человека и являются незаменимыми факторами питания. К ним относятся: валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин, лизин. Белки, содержащие весь комплекс незаменимых аминокислот, называются полноценными. Они содержатся в молоке, курином яйце, мясе, рыбе, сое. Белки, в составе которых отсутствует хотя бы одна незаменимая аминокислота, называются неполноценными.
Билет 2. Нобелевкие лауреаты. Якоб Хендрик Вант-Гофф(1901) -в знак признания огромной важности открытия законов химической динамики и осмотического давления в растворах. Фишер (1902)- за эксперименты по синтезу веществ с сахаридными и пуриновыми группами Бухнер(1907) -за проведённую научно-исследовательскую работу по биологической химии и открытие внеклеточной ферментации Вальтер Герман Нернст (присуждена в 1921 г.)-В признание его работ по термодинамике Отто Виланд (присуждена в 1928 г.) -присуждена Нобелевская премия за исследования строения жёлчных кислот и аналогичных соединений Уолтер Норман Хоуорс(1937)- за исследования углеводов и витамина С Макс Фердинанд Перуц, Джон Кодери Кендрю(1962) -за исследования структуры глобулярных белков Уолтер Гилберт, Фредерик Сенгер (1980) -за фундаментальные исследования биохимических свойств нуклеиновых кислот, в особенности рекомбинантных ДНК Ханс Адольф КРЕБС - внёс основной вклад в разработку цикла трикарбоновых кислот (цикл Кребса). В 1932 описал орнитиновый цикл синтеза мочевины в печени животных.Лауреат Нобелевской премии по медицине в 1953 г. совместно с Фрицем Липманом.
Амфотерность Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2- и СООН-групп. Для них характерны все свойства кислот и оснований. В зависимости от реакции среды и соотношения кислых и основных аминокислот белки в растворе несут или отрицательный, или положительный заряд, перемещаясь к аноду или катоду. Это свойство используется при очистке белков методом электрофореза.
Белки обладают явно выраженными гидрофильными свойствами. Растворы белков имеют очень низкое осмотическое давление, высокую вязкость и незначительную способность к диффузии. Белки способны к набуханию в очень больших пределах. Ионизация белков. Ионизация белковых молекул зависит от рН среды.При определенном значении рН число положительно и отрицательно заряженных групп может быть одинаковым. Такое состояние белковой молекулы называется изоэлектрическим состоянием (суммарный заряд молекулы белка равен нулю).Значение рН при котором белок находится в изоэлектрическом состоянии, называют изоэлектрической точкой (рI). Пепсин имеет рI = 1, сальмин рI=12, альбумины рI=7. Изоэлектрическая точка большинства белков лежит в слабокислой зоне. Это связано с тем, что обычно в белках анионогенных аминокислот (моноаминодикарбоновых) больше, чем катионогенных. Однако есть белки и щелочного характера, это сальмин и гистоны. R---CH--(NH2)n R---CH--(NH3+)n | | C=O C=O | | NH NH | + Н2О | . --------->. | | C=O C=O | | NH NH | | R---CH--(COOH)n R---CH--(COO-)n Гидратация Диссоциация ионогенных групп приводя к появлению заряда у молекулы белка, обеспечивает дополнительную фиксацию дипольных молекул воды в гидратной оболочке.
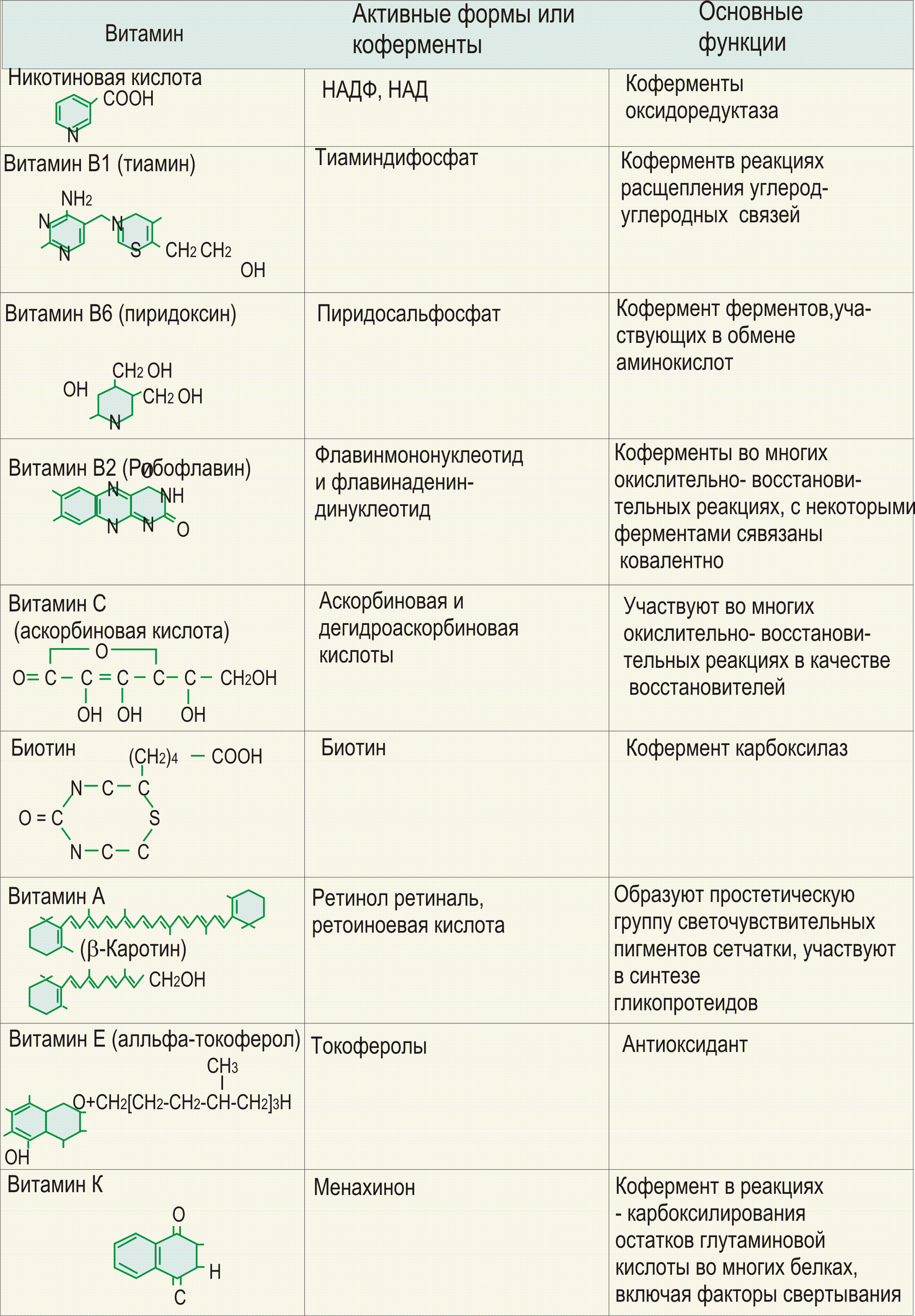
Билет 3. Незаменимые жирные кислоты α-линоленовая кислота (омега-3 жирная кислота с кратчайшей цепочкой), линолевая кислота (омега-6 жирная кислота с кратчайшей цепочкой). Витамины биотин (витамин B7, витамин H), холин (витамин Bp), фолат (фолиевая кислота, витамин B9, витамин M), ниацин (витамин B3, витамин P, витамин PP), пантотеновая кислота (витамин B5), рибофлавин (витамин B2, витамин G), тиамин (витамин B1), витамин A (ретинол), витамин B6 (пиридоксин, пиридоксамин или пиридоксаль), витамин B12 (кобаламин), витамин C (аскорбиновая кислота), витамин D (эргокальциферол или холекальциферол), витамин E (токоферол), витамин K (нафтохиноны). Лизин принимает активное участие в синтезе гормонов, антител, ферментов, восстановлении и формировании тканей и коллагена. Эта незаменимая аминокислота входит в состав практически всех белков. Лизин поддерживает необходимый уровень азота в крови, способствует усвоению кальция в организме и является неотъемлемой составляющей правильного формирования скелета у детей. Пищевые добавки, включающие в свой состав лизин, обычно принимают для восстановления организма после спортивных травм и различных операций. Лизин содержат в себе такие продукты, как мясо, рыба, орехи, пшеница и молоко. Валин также необходим для человека. Эта аминокислота поддерживает нормальный уровень азота в организме, способствует восстановлению повреждённых тканей и, что важно для спортсменов, является источником энергии для для мышечных тканей. Валин содержится в молочных продуктах, грибах, арахисе, мясе и зерновых. Рекомендуется сочетать приём валина с приёмом таких аминокислот, как L-изолейцин и Д-лейцин.
Лейцин является источником энергии для организма, защищает мышечные ткани, способствует быстрому заживлению костей, кожных покровов и мышц, а также снижает уровень холестерина. При дефиците лейцина наблюдается уменьшение массы тела, задержка роста, возникают патологии почек и щитовидной железы. Лейцин содержится в орехах, чечевице, буром рисе, мясе, рыбе и большинстве семян. Приём лейцина в виде пищевых добавок следует применять в комплексе с изолейцином и валином.
Изолейцин обладает очень важным свойством для организма, он играет ключевую роль для синтеза гемоглобина. К тому же эта незаменимая аминокислота с разветвлёнными боковыми цепями регулирует процессы энергообеспечения и избавляет от усталости мышц при перенапряжении и сильном утомлении. Изолейцин является неотъемлемой частью питания для спортсменов, так как увеличивает выносливость и восстанавливает мышечные ткани. К пищевым источникам изолейцина относятся: куриное мясо, кешью, яйца, рыба, чечевица, мясо, рожь, миндаль, нут (турецкий горох), печень, соя.
Метионин – это незаменимая аминокислота, которая необходима для важных функций организма. Она способствует нормальному пищеварению, сохранению здоровой печени, участвует в переработке жиров и является мощным антиоксидантом. Метионин содержится в следующих пищевых продуктах: йогурт, мясо, молоко, бобовые, чеснок, лук, чечевица, семена, соевые бобы.
Треонин – незаменимая аминокислота, которая принимает участие в обмене жиров, синтезе коллагена и эластина, контролирует работу печени и способствует поддержанию нормального белкового обмена. Она необходима организму для синтеза антител и иммуноглобулинов, а также для правильной работы иммунной системы. Треонин содержится в яйцах, молочных продуктах, бобах и орехах. Фенилаланин является нейромедиатором для нервных клеток головного мозга. В организме человека фенилаланин превращается в допамин и норадреналин, которые обеспечивают выносливость и бодрость. Фенилаланин эффективно помогает при депрессии, артрите, мигрени, ожирении. Пищевые добавки, содержащие эту аминокислоту нельзя принимать диабетикам, беременным женщинам, лицам с высоким артериальным давлением. Следует знать, что фенилаланин не усваивается организмом, которому не хватает витамина С.
Триптофан – это незаменимая кислота, используемая мозгом для производства серотонина, одного из важнейших нейромедиаторов. Триптофан способствует естественному и здоровому сну, уменьшает напряжение и беспокойство, стабилизирует настроение. Уменьшает симптомы биохимических нарушений в организме и препятствует развитию алкоголизма. Спортсмены принимают триптофан для снижения аппетита, контроля за массой тела и увеличения выброса гормонов роста. Пищевые источники триптофана – это курица, индейка, молоко, йогурт, овёс, бананы, кунжут, арахис, творог, кедровые орехи.
Катаболические реакции. Катаболи́зм (от греч. καταβολή, «сбрасывание, разрушение») или энергетический обмен — процесс метаболического распада, разложения на более простые вещества (дифференциация) или окисления какого-либо вещества, обычно протекающий с высвобождением энергии в виде тепла и в виде АТФ. Катаболические реакции лежат в основе диссимиляции: утраты сложными веществами своей специфичности для данного организма в результате распада до более простых.
Билет № 4. Простые белки. 1.Протамины и гистоны - это обширная группа белков щелочного характера, поскольку в составе в большом количестве присутствуют диамино-монокарбоновые кислоты (лиз, арг, гис). Это белки с небольшой молекулярной массой, хорошо гидратируются. Гистоны принимают участие в формировании хромосом и являются регуляторами функций генов оперона. 2.Проламины и глютелины являются растительными белками, проявляют свойства энзимов и являются резервными белками семян растений. Это белки клейковины пшеницы - глиадин и глютенин, белок риса - оризеин, ячменя - гордеин, кукурузы - зеин. Глютелины ни в воде, ни в разбавленном нейтральном солевом растворе не растворяются. Протамины не растворяются в чистой воде и растворяются в слабых солевых растворах и в 70% спирте. 3.Протеиноиды или склеропротеины это не растворимые в воде белки опорных тканей. Они почти не подвергаются действию пищеварительных энзимов в желудочно-кишечном тракте и поэтому не пригодны в пищу человеку. К этой группе относится белок коллаген и эластин соединительной ткани, кератин волос, ногтей, перьев. При длительном кипячении коллагена с водой свойства коллагена меняются, и он становится водо-растворимым, способным к гелеобразованию (желатинированию). Этот видоизмененный коллаген называется желатин. 4.Альбумины и глобулины - наиболее широко распространенная группа простых белков. К ним относятся белки молока, сыворотки крови, яичный белок, белки мышц и др. Альбумины и глобулины отличаются друг от друга разной растворимостью, что можно использовать для их выделения и фракционирования: Сложные белки 1.Фосфопротеиды состоят из простого белка и простетической группы представленной радикалом фосфорной кислоты, присоединенной к апопротеину через ОН- группу серина эфирной связью. К фосфопротеидам относится казениноген молока, ововителин и фосвитин яичного желтка, овальбумин, пепсин, фосфорилазы и др. белки. 2.Х ромопротеиды, простетическая группа представлена различными окрашенными соединениями. К этой группе белков относится гемоглобин, миоглобин и цитохромы, у которых гем и его производные являются небелковым компонентом. К хромопротеидам относятся флавопротеиды, простетическая группа которых представлена производными рибофлавина, родопсин - светочувствительный белок сетчатки, простетическая группа которого - ретиналь (вит А). 3.Нуклеопротеиды - простетическая группа представлена нуклеиновыми кислотами. Различают два типа нуклеопротеидов: дезоксирибонуклеопротеиды, простетическая группа которых представлена ДНК и рибонуклеопротеиды, простетическая группа которых представлена РНК Апопротеины нуклеопротеидов представлены протаминами или гистонами - простыми белками щелочного характера. 4.Липопротеиды (протеолипиды) представляют комплексы белков и жироподобными соединениями, структура которых крайне неустойчива. Липопротеиды принимают участие в формировании мембран и образуют транспортные формы в сыворотке крови: альфа и бета-липопротеиды. - Гликопротеиды это белки, простетическая группа которых представлена в основном нейтральными мукополисахаридами (сиаловыми кислотами). К ним относятся некоторые гормоны, ферменты и белки плазмы крови (ФСГ, ГТГ, холинэстераза, протромбин, фибриноген, иммуноглобулины, группоспецифические белки крови и др.). -Протеогликаны (гликопротеиды) представлены муцинами и мукоидами. К муцинам относятся муцин слюны и муцины слизистой желудочно-кишечного тракта. Простетическая группы у этих белков представлена гиалуроновой кислотой. Мукоиды образуют в воде очень вязкий раствор и встречаются в основном веществе соединительной ткани, в выделениях слизистых оболочек, в синовиальных жидкостях, в стекловидном теле глаза, в яичном белке. К мукоидам относятся овомукоиды, остеомукоиды, хондромукоиды, гиаломукоиды. Простетическая группа этих белков образована хондроитинсульфатами. Мукоид - гепаринфибринолизин содержит мукополисахарид - гепарин. 6. Металлопротеиды - белки, в состав которых входят металлы. К этой группе относится трансферрин, ферритин - содержащие железо, церулоплазмин - содержащий медь и другие белки. Витамин В2 (Рибофлавин) В основе молекулы рибофлавина лежит гетероциклическое соединение — изоаллоксазин (сочетание бензольного, пиразинового и пиримидинового колец), к которому в положении 9 присоединен пятиатомный спирт рибитол. Химическое название «рибофлавин» отражает наличие рибитола и желтой окраски препарата; рациональное название его 6,7-диметил-9-В-ри6итилизоаллоксазин:
Рибофлавин входит в состав флавиновых коферментов, в частности ФМН и ФАД1, являющихся в свою очередь простетическими группами ферментов-флавопротеинов. Различают два типа химических реакций, катализируемых этими ферментами. К первому относятся реакции, в которых фермент осуществляет прямое окисление с участием кислорода, т. е. дегидрирование (отщепление электронов и протонов) исходного субстрата или промежуточного метаболита. К ферментам этой группы относятся оксидазы L- и D-аминокислот, глициноксидаза, альдегидоксидаза, ксантиноксидаза и др. Вторая группа реакций, катализируемых флавопротеинами, характеризуется переносом электронов и протонов не от исходного субстрата, а от восстановленных пиридиновых коферментов. Ферменты этой группы играют главную роль в биологическом окислении. В каталитическом цикле изоаллоксазиновый остаток ФАД и ФМН подвергается обратимому восстановлению с присоединением атомов водорода к N1 и N10. ФМН синтезируется в организме животных из свободного рибофлавина и АТФ при участии специфического фермента - рибофлавинкиназы:
Образование ФАД в тканях также протекает при участии специфического АТФ-зависимого фермента ФМН-аденилилтрансферазы. Исходным веществом для синтеза является ФМН:
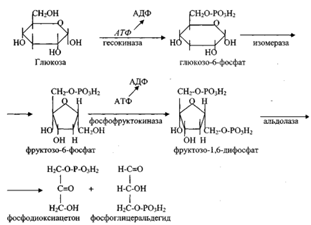
Билет №6. Витамин В1 (Тиамин) Витамин В1 (тиамин, антиневритный), наряду с аминогруппой витамин B1 содержит атом серы, поэтому он был назван тиамином. В химической структуре его содержатся два кольца — пиримидиновое и тиазодовое, соединенных метиленовой связью. Возможность каталитического действия тиамина на уровне окислительно-восстановительных реакций в обмене давно допускают и критикуют разные авторы. Действительно, различная обеспеченность витамином влияет на активность ряда окислительных ферментов или содержание в крови восстановительных форм глютатиона. Экспериментально доказано, что витамин B1 в форме ТПФ является составной частью минимум четырех ферментов, участвующих в промежуточном обмене веществ. Так, известно, что ТПФ входит в состав двух сложных ферментных систем - п и р у в а т- и альфа-кетоглутаратдегидрогеназных комплексов, катализирующих окислительное декарбоксилирование пировиноградной и а-кетоглутаровой кислот. В составе транскатолазы ТПФ участвует в переносе гликольальдегидного радикала от кетосахаров на альдосахара. ТПФ является коферментом дегидрогеназы у-оксикетоглутаровой кислоты. Приведенные примеры, вероятно, не ограничивают биологические функции тиамина. В частности, ТПФ участвует в окислительном декнрбоксилировании глиоксиловой кислоты и а-кетокислот, образующихся при распаде аминокислот с разветвленной боковой цепью. Билет 7. 1. Роль биохимии в формировании компетенции врача. Роль биохимии в профессии врача состоит в том, чтобы решить проблемы сохранения здоровья человека и выяснить причины различных болезней и найти пути их эффективного лечения. Одной из главных предпосылок сохранения здоровья является оптимальная диета, содержащая ряд химических веществ; главными из них являются витамины, некоторые аминокислоты, некоторые жирные кислоты, различные минеральные вещества и вода. 2. Структура и типы простых белков. Белки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот. Все белки классифицируются на две группы: простые (протеины) и сложные (протеиды или холопротеины). Простые белки при гидролизе разрушаются до аминокислот(АМК), т.е построены только из остатков АМК, образующие полипептидные цепи субъединиц. Простые белки делятся на следующие группы: · Протамины и гистоны · Глютелины и проламины · Альбумины и глобулины · Протеиноиды (склеропротеины) Протамины и гистоны – обширная группа белков щелочного характера, поскольку в составе имеют диамино – монокарбоновые кислоты (лиз.арг.гис) Гистоны находятся в ядрах клеток. Протамины содержатся в половых клетках животных и человека. Альбумины и глобулины.. Самая распространённая группа белков. Молекулярная масса 25000-70000. Водорастворимые белки. Составляют 50% плазмы крови. Глобулины. Сходны по составу с альбуминами, но отличаются более высоким содержанием глицина. Нерастворимы в воде. Распространены в семенная масличных и бобовых растений Протеиноиды или склеропротеины. Нерастворимы в воде, солевых растворах, разведённых кислота и щелочах. Богаты глицином, пролином, цистином. Пример: коллаген, эластин соед.ткани, кератин волос, ногтей, перьев. При длительном кипячении коллаген меняет свойства, становится водорастворимым, способным к желатинированию.(желатин). ATF H – C =O O = C –PO3H2 ↑ | 2НАД+2Н3РО4 | +2ADF 2H-C-OH ----------------------> 2 Н – С – ОН --------------------> | ДЕГИДРОГЕНАЗА | КИНАЗА H2C-O-PO3H2 H2C – O – PO3H2 СООН СООН / / 2НОН ↓ 2Н – С – ОН ----------------->2Р-С-О-РО3Н2 ----------------------------> / МУТАЗА / ЕНОЛАЗА Н2С-О-РО3Н2 СН2-ОН ФОСФОГЛИЦЕРАТ ФОСФОГЛИЦЕРАТ СООН СООН COOH / / | 2 С –О-РО3Н2 -----------------> 2 С – ОН ----------------> 2 С = O // КИНАЗА // | СН2 СН2 CH3 NAD ↑ COOH 2NADN2 | -------------------------------> 2 H- C-OH LDG 1-5 | CH3 (LAKTAT) БИЛЕТ 8. 1.МЕТОДЫ СТАТИСТИЧЕСКОЙ БИОХИМИИ. Биохимию принято делить на статическую и динамическую.Задачастатической биохимии -- изучение химического состава и свойств веществ живых организмов. Метод синтеза в изучении структуры белков позволил выяснить весьма существенное в их строении - способ соединения аминокислот друг с другом (пептидные связи) в молекулах белка и затем выяснить последовательность расположения аминокислотных остатков в полипептидных цепях белковых молекул. Следует уделить особое внимание методу радиоактивных изотопов, который дает возможность проследить за перемещением того или иного вещества в организме. Этот метод дал возможность расшифровать многие биохимические процессы, которые происходят в отдельных органах. Нарушение переваривания и всасывания липидов. При некоторых состояниях организма переваривание и всасываниЕ липидов нарушается. Нарушениия переваривания липидов наблюдается при недостатке липолитических ферментов в панкреатическом соке или при вследствие нарушения поступления сока поджелуд железы в кишечник. Нарушается процесс переваривания и всасывания продуктов переваривания липидов при недостатке желчных кислот в желчи или при нарушении оттока желчи в кишечник. Основным признаком нарушения переваривания липидов является стеаторея, т.е выделение не переваренных липидов с калом, который приобретает белый цвет из-за содержания в нем не переваренных липидов. Билет 9. Билет Химизм глюконеогенеза.
Глюконеогенез — процесс образования в печени и отчасти в корковом веществе почек (около 10 %) молекул глюкозы из молекул других органических соединений — источников энергии, например свободных аминокислот, молочной кислоты, глицерина. Свободные жирные кислоты у млекопитающих для глюконеогенеза не используются. Билет Строение и функции ДНК
Функции ДНК: Оксидоредуктазы (Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе процессов биологического окисления, осуществляемое реакциями переноса атомов водорода, электронов или кислорода.) В этом классе 17 подклассов 2. Трансферазы (Ферменты этого класса катализируют перенос функциональных групп и делятся по этому принципу на 8 подклассов) 3. Гидролазы (Этот класс ферментов катализирует реакции гидролиза, и в зависимости от типа гидролизируемой связи делятся на 11 подклассов) Лигазы (Этот класс ферментов катализирует реакции синтеза соединений с использованием энергии АТФ и других аналогичных макроэргов, или с использованием биотина и делятся на 5 подклассов по типу образующихся связей)
Т.к. число известных ферментов все вемя растет, в 1972 году комиссия по номенклатуре фементов опубликовалановые «Правила номенклатуры ферментов» в которой кроме систем названия у фемента имеется шифр, состоящий из 4 цифр. Первая – номер класса, вторая – подкласс, третья – под подкласс, четвертая – порядкоый номер фемента. Синтез простогландинов Арахидоновая кислота как источник простагландинов подвергается действию фермента циклооксигеназы, входящей в состав полиферментного комплекса - простагландинсинтетазы. Циклооксигеназа катализирует этот процесс только в присутствии кислорода. В результате образуются биологически активные промежуточные продукты - эндопероксиды простагландинов, называемые также простагландины G2 и Н2 (ПГG2, ПГН2). В стенке сосудов из эндопероксида типа ПГG2 синтезируется простациклин I (ПГI2) - сильнейший природный ингибитор агрегации тромбоцитов. В большинстве тканей из ПГН2 синтезируются простагландины типа ПГЕ2, ПГF2a, ПГА2, ПГD2 и тромбоксаны. При изомеризации двойной связи в циклопентановом кольце ПГА2 образуются ПГС2 и ПГВ2. В лейкоцитах метаболизм арахидоновой кислоты идет по иному пути. С участием фермента липооксигеназы она превращается в нециклические ненасыщенные производные, которые получили название лейкотриенов (ЛТ) типа А,В,С,D,Е (ЛТА, ЛТВ, ЛТС, ЛТD, ЛТЕ).
Билет 1. Роль биохимии в подготовке врача. Цель курса биохимии — научить будущих врачей применять при изучении последующих дисциплин и в профессиональной врачебной деятельности сведения о химическом составе и молекулярных процессах организма как о характеристиках нормы и признаках патологии. Исходя из этого, в предлагаемом издании особое внимание уделяется сведениям о непосредственной связи молекулярных процессов с физиологическими (биологическими) функциями клетки и организма. Сведения о молекулярных механизмах патогенеза болезней, имеющиеся в каждой главе, выполняют не только информативную, но и мотивационную роль, поскольку подчеркивают значение биохимии для изучения клинических дисциплин и для будущей профессиональной деятельности. Установление диагноза болезни и назначение адекватного лечения начинаются с отбора. Отобранные симптомы складываются в клиническую картину, на основе которой делают заключение о сущности болезни и, устанавливают диагноз больного. А сущности болезней, равно как мишени и механизмы действия лекарств и лечебных мероприятий, описываются в терминах и понятиях морфологии, физиологии и биохимии. При этом клиницисту требуется интегральное описание морфологии, физиологии и биохимии патологических состояний: нет такой функции и нет такой болезни, которые можно было бы описать в рамках одной или двух из этих дисциплин.
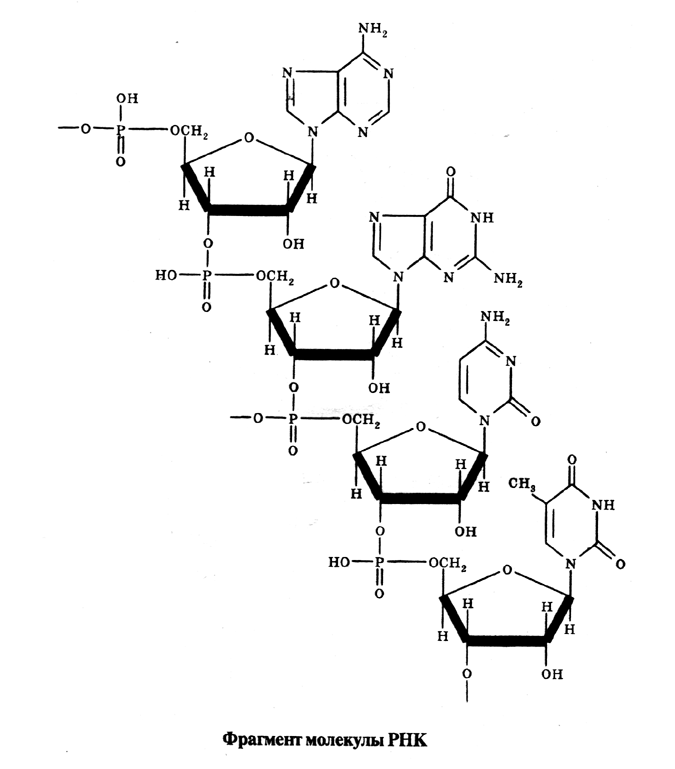
Функции РНК различаются в зависимости от вида рибонуклеиновый кислоты. 1) Информационная РНК (и-РНК).. Основное назначение – перенос информации о строении белка от дезоксирибонуклеиновой кислоты к рибосомам, где и происходит сбор белковой молекулы. Относительно небольшая популяция молекул РНК, составляющая менее 1% от всех молекул. 2) Рибосомная РНК (р-РНК). 4) Минорные (малые) РНК. Билет
Биохимические принципы, подходы и методы позволили в определенной мере расшифровать основные закономерности функциональной организации биосистем. Благодаря биохимии стали объяснимы такие свойства живых систем как: · сложность структурной организации; · питание и обмен веществ; · дыхание; · наследственность и изменчивость; · многообразие форм и видов; · рост и развитие; · способность извлекать и преобразовывать энергию; · способность к сохранению структурно-функциональной целостности организма; · активное, незавизимое передвижение в пространстве; · самовоспроизводство себе подобных; · приспособляемость; · раздражимость. Все свойства живых систем имеют материальную основу, которая определяется, формируется и функционирует благодаря структурной организации химических соединений в клетку. КЛЕТКА
ОРГАНЕЛЛЫ: белки....аминокислоты НК....нуклеотиды липиды.....жирные к-ты и глицирин полисахариды.....моносахариды
Вся информация о человеке хранится в хромасомах. Хромосомы по своей химической природе являются нуклеопротеодами. Нуклеопротеиды состоят из белковой части (гистоны, протамины) и простетической группы (НК).Высокополимерные ДНК в комплексе с молекулами белков и составляют хромасому. Молекула ДНК за счет остатков фосфорной кислоты заряжается отрицательно и присоединяет к своей поверхности положительно заряженные белки, образую сложный белок дезоксирибонуклеопротеид называемый хроматином. Спираль ДНК соединяется с группами из 8 молекул гистона и образует нуклеосомы — частицы, имеющие вид нанизанных на нитку бусинок. Эти нуклеосом и соединяющие их участки ДНК плотно упакованы в виде спирали толщиной в 36 нм. На каждый виток спирали приходится примерно 6 нуклеосом, которые по своим размерам и другим признакам соответствуют хромомере хромосом. Все хромосомы состоят из двух хромомер и соеденены друг с другом центральными двумя нитями ДНК. Функции хромосом заключается: В хранении наследственной информации. Хромосомы являются носителями генетической информации. Сформулированы основные принципы структурной организации рибосомы: 1) рибосома построена из двух неравных субчастиц; 2) высокополимерная РНК каждой рибосомной субчастицы компактно свернута специфическим образом, формируя структурное ядро рибосомной субчастицы; 3) разнообразные рибосомные белки собраны на ядре РНК как на каркасе, так что каждый белок узнает свою посадочную площадку. Рибосомы представляют собой субклеточные частицы с козффициенто седиментации 80S и молекулярной массой 4,5 млн. Они состоят из двух субъединиц — большой (60S) и малой (40S). Каждая из субъединиц содержит РНК и белки. Функции рибосом: синтез белков.
2 класс ферментов — трансферазы. Ферменты этого класса катализируют перенос функциональных групп и делятся по этому принципу на 8 подклассов:
Витамин PP существует в двух формах - никотиновой кислоты и никотиномида. Источники Говяжья печень, дрожжи, брокколи, морковь, сыр, кукурузная мука, листья одуванчика, финики, яйца, рыба, молоко, арахис, свинина, картофель, помидоры, проростки пшеницы, продукты из цельных злаков. Травы, богатые витамином PP: люцерна, корень лопуха, котовник кошачий, кайенский перец, ромашка, песчанка, очанка, семя фенхеля, пажитник сенной, женьшень, хмель, хвощ, коровяк, крапива, овес, петрушка, мята перечная, листья малины, красный клевер, плоды шиповника, шалфей, щавель. Действие Активное воздействие витамина PP на обменные процессы обусловлено его вхождением в состав ниацинамидадениндинуклеотида (НАД) и ниацинамидадениндинуклеотида фосфата (НАДФ), являющихся кофакторами ряда ферментов. В частности, ниацинамид входит в состав кодегидраз, являющихся переносчиками водорода к флавопротеиновым ферментам, и тем самым регулирует окислительно-восстановительные процессы в организме.
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ, синтез АТФ из аденозиндифосфата и неорг. фосфата, осуществляющийся в живых клетках, благодаря энергии, выделяющейся при окислении орг. в-в в процессе клеточного дыхания. В общем виде окислительное фосфорилирование и его место в обмене в-в можно представить схемой:
В молекуле АДФ только одна высокоэнергетическая связь, в результате синтеза АТФ путем окислительного фосфорилирования добавляется еще одна, т.е. Энергия окисления субстрата трансформируется в энергию химических связей в молекуле АТФ. Т.е. Главный путь синтеза АТФ из АДФ — окислительное фосфорилирование, при этом Адф фосфорилируется неорганическим фосфатом: АДФ + Н3 РО4 + энергия --- АТФ + Н2 О Синтез АТФ осуществляется на уроне трех участков дыхательной цепи митохондрий, где имеется достаточной величины разность редокс-потенциалов. Первый участок м/у НАД и ФМН (0,21в), второй — м/у b и c (0,22в), третий м/у цитохромоксидазой(а+а3) и кислородом (0,29в). Для качественной оценки был введен покзатель окислительного фосфолирирования- коэффициент Р/0 — отношение количества молек
|
||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 692; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.021 с.) |