Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изоэлектрическое состояние и изоэлектрическая точка белков
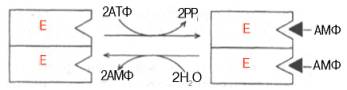
Изоэлектрической точкой называют такую концентрацию водородных ионов, т. е. такое значение рН, при котором имеется равновесная концентрация положительных и отрицательных зарядов у белковой молекулы. При изоэлектрической точке молекула белка электронейтральна и не передвигается в электрическом поле. В таком состоянии молекулы белка легко выпадают в осадок, чем и пользуются для разделения белковых веществ при их совместном присутствии. Как видно из табл. 4, большинство белков имеют изоэлектри-чеекую точку при рН от 4,0 до 8,0. Изоэлектрическая точка фермента желудочного сока пепсина находится в резко кислой среде при рН 1,0, а химотрипсина при рН 8,1. При изоэлектрической точке молекула белка электронейтральна и не передвигается в электрическом поле. В таком состоянии молекулы белка легко выпадают в осадок, чем и пользуются для разделения белковых веществ при их совместном присутствии. Как видно из табл. 4, большинство белков имеют изоэлектри-чеекую точку при рН от 4,0 до 8,0. Изоэлектрическая точка фермента желудочного сока пепсина находится в резко кислой среде при рН 1,0, а химотрипсина при рН 8,1. При изоэлектрической точке молекула белка электронейтральна и не передвигается в электрическом поле. В таком состоянии молекулы белка легко выпадают в осадок, чем и пользуются для разделения белковых веществ при их совместном присутствии.Большинство белков имеют изоэлектри-чеекую точку при рН от 4,0 до 8,0. Изоэлектрическая точка фермента желудочного сока пепсина находится в резко кислой среде при рН 1,0, а химотрипсина при рН 8,1. Белковые вещества в водной среде проявляют свойства амфо-терности, т. е. они ведут себя и как кислоты, имея карбоксильные группы, и как основания благодаря наличию аминных групп. Однако если раствор белка подкислять, то его кислотная диссоциация будет подавляться, белок заряжается положительно, образуется катион белка. Если добавлять щелочь, то щелочная диссоциация белка будет подавляться, белок заряжается отрицательно, появится анион белка. Следовательно, поведение белков в электрическом поле будет зависеть от аминокислотного состава их, что и используют для разделения белков на фракции при электрофорезе. Если в белках преобладают аминокислоты, содержащие по две карбоксильные группы (глютаминовая и аспарагиновая кислоты), такие белки в электрическом поле будут передвигаться к аноду (+), а белки, содержащие основные аминокислоты (аргинин, лизин и гистидин), будут передвигаться к катоду (-). Различают электрофорез на гелях — крахмальном, агаровом, полиакриламидном и т. д.
В последнее время наиболее часто для разделения белков, содержащихся в биологических жидкостях, применяют сефадексы1, «молекулярные» сита. При этом белковые молекулы отделяются друг от друга в зависимости от величины и их электрического заряда. Для этой цели используют катиониты и аниониты.
3)влияние концентрации субстрата на активность ферментов Влияние концентрации водородных ионов на каталитическую активность ферментов состоит в воздействии ее на активный центр. При разных значениях рН в реакционной среде активный центр может быть слабее или сильнее ионизирован, больше или меньше экранирован соседними с ним фрагментами полипептидной цепи белковой части фермента и т.п. Кроме того, рН среды влияет на степень ионизации субстрата, фермент-субстратного комплекса и продуктов реакции, оказывает большое влияние на состояние фермента, определяя соотношение в нем катионных и анионных центров, что сказывается на третичной структуре белковой молекулы. Последнее обстоятельство заслуживает особого внимания, так как определенная третичная структура белка-фермента необходима для образования фермент-субстратного комплекса.
Специфичность - одно из наиболее выдающихся качеств ферментов. Эго свойство их было открыто еще в прошлом столетии, когда было сделано наблюдение, что очень близкие по структуре вещества - пространственные изомеры (?- и?-метилглюкозиды) расщепляются по эфирной связи двумя совершенно разными ферментами.
Таким образом, ферменты могут различать химические соединения, отличающиеся друг от друга очень незначительными деталями строения, такими, например, как пространственное расположение метоксильного радикала и атома водорода при 1-м углеродном атоме молекулы метилглюкозида. 4)гиповитаминоз в1 причины и последствия
описание. Гиповитаминоз В1 сопровождается нарушением окисления углеводов, накоплением недоокисленных продуктов и снижением синтеза ацетилхолина. Лабораторно при дефиците витамина В1 уровень тиамина в плазме крови менее 14,8 ммоль/л, в суточной моче менее 100 мкг, уровень пировиноградной кислоты в плазме более 0,114 ммоль/л и суточной моче более 30 мг.
Симптомы Гиповитаминоза В1:
Клиническая картина В1-дефицита характеризуется повышенной раздражительностью, плохим сном, рассеянностью, забывчивостью, зябкостью, болями в животе, склонностью к рвоте, дискинезии желудка и кишечника, секреторным расстройствам. К числу ранних симптомов недостатка В1 относят изменения языка. Он становится суховатым, тёмно-красного цвета с маловыраженными сосочками. У детей отчётливо выражены изменения со стороны нервной системы: они капризны, быстро утомляются, жалуются на неопределённые боли по ходу нервов. Сухожильные рефлексы снижены. У маленьких детей нередко наблюдается гиперстезия, плаксивость, плохой сон, угасание рефлексов, общая и частичная скованность.
Причины Гиповитаминоза В1: К числу факторов риска развития гиповитаминоза В1 (тиамина) относят недостаточное употребление продуктов питания с антитиаминными свойствами: рыба семейства карповых, атлантическая сельдь, чай, кофе, брюссельская капуста, красный цикорий, черника, чёрная смородина. На потребность в тиамине существенно влияют степень физической нагрузки, повышенная или пониженная температура окружающей среды; особую группу причин недостаточности тиамина составляют заболевания желудочно-кишечного тракта и печени. В организме человека тиамин не депонируется. При исключении тиамина из рациона питания симптомы недостаточности появляются через 14—21 день. последствия гиповитаминоза При тяжелом авитаминозе B1 развивается болезнь «бери-бери» с поражением нервной системы в виде полиневритов и параличей, формированием сердечно-сосудистой недостаточности, хронических запоров, склонности к отекам. 5)биоэнергетика митохондриального окисления аэробными дегидрогеназами В аэробном гликолизе можно выделить 2 этапа. Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ. Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
2. Реакции аэробного гликолиза
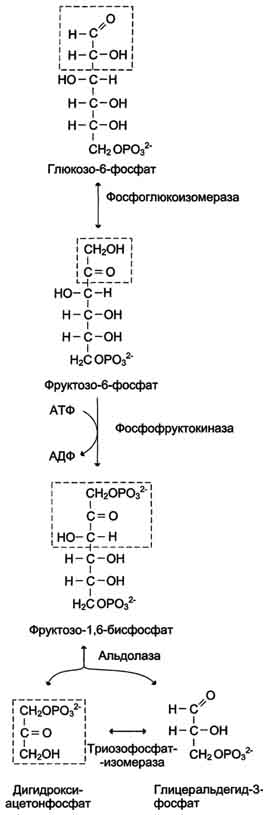
Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата
Глюкозо-6-фосфат, образованный в результате фосфорилирования глюкозы с участием АТФ, в ходе следующей реакции превращается в фруктозо-6-фосфат. Эта обратимая реакция изомеризации протекает под действием фермента глюкозофосфатизомеразы.
Затем следует ещё одна реакция фосфорилирования с использованием фосфатного остатка и энергии АТФ. В ходе этой реакции, катализируемой фосфофруктокиназой, фруктозо-6-фосфат превращается в фруктозо-1,6-бисфосфат. Данная реакция, так же, как гексокиназная, практически необратима, и, кроме того, она наиболее медленная из всех реакций гликолиза. Реакция, катализируемая фосфофруктокиназой, определяет скорость всего гликолиза, поэтому, регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы.
6)метаболиты дихотомического пути катаболизм. м глюкозы Окислительное декарбоксилирование пирувата
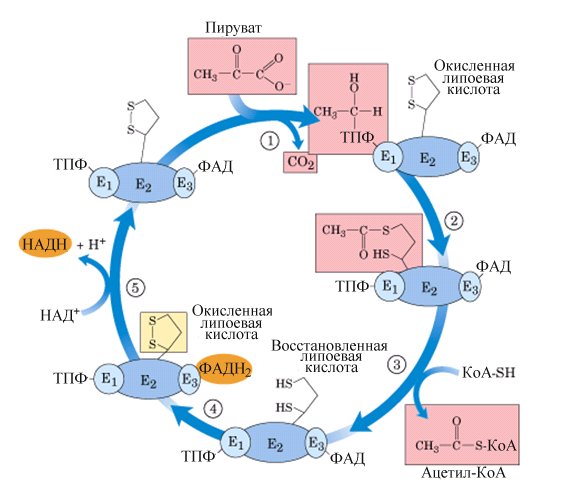
Пируват, образовавшийся в реакциях гликолиза (в цитоплазме), должен быть транспортирован в митохондрии. Транспорт осуществляется специальной «челночной» системой. В матриксе митохондрии, прикрепившись к ее внутренней мембране, находится сложный полиферментный комплекс – пируватдегидрогеназа.
Пируватдегидрогеназа состоит из 60 полипептидных цепей, которые можно разделить на 3 основных фермента: Е1 – собственно пируватдегидрогеназа (состоит из 24 субъединиц); Е2 – дигидролипоилтрансацетилаза (также 24 субъединицы); Е3 – дигидролипоилдегидрогеназа (12 субъединиц).
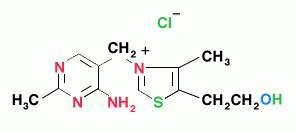
Последовательность реакций представлена на рис.5.12. Е1 катализирует декарбоксилирование ПВК с участием кофермента тиаминпирофосфата (ТПФ). Образовавшийся продукт реакции (гидроксиэтильное производное ТПФ) при участии Е2 реагирует с окисленной липоевой кислотой(ЛК). Липоевая кислота – низкомолекулярное азотсодержащее соединение – является коферментом Е2.
CH2
СН2 СН – (СН2)4 – СООН
S – S
Липоевая кислота
Дисульфидная группа ЛК способна восстанавливаться и ацетилироваться. В реакции, катализируемой дигидролипоилтрансацетилазой (Е2), образуется ацетиллипоевая кислота. Далее это соединение реагирует с коэнзимом А (КоА-SH не является собственным коферментом Е2) – при этом образуется восстановленная форма ЛК (дигидролипоевая кислота) и ацетил-КоА.
Наконец, начинает функционировать Е3, коферментом которого является ФАД: кофермент окисляет дигидролипоевую кислоту и сам при этом восстанавливается (ФАДН2). Восстановленный флавиновый кофермент реагирует с митохондриальным НАД+, в свою очередь, восстанавливая его (НАДН ·Н+).
Таким образом, в окислительном декарбоксилировании ПВК участвует фактически три фермента, составляющих единый пируватдегидрогеназный комплекс, и 5 коферментов: ТПФ, ЛК и ФАД – собственные коферменты комплекса, КоА-SH и НАД+ – внешние, приходящие “извне”. Образующийся ацетил-КоА затем окисляется в цикле Кребса, а водород с НАДН ·Н+ поступает в дыхательную цепь митохондрий
|
|||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 1383; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.82.23 (0.011 с.) |