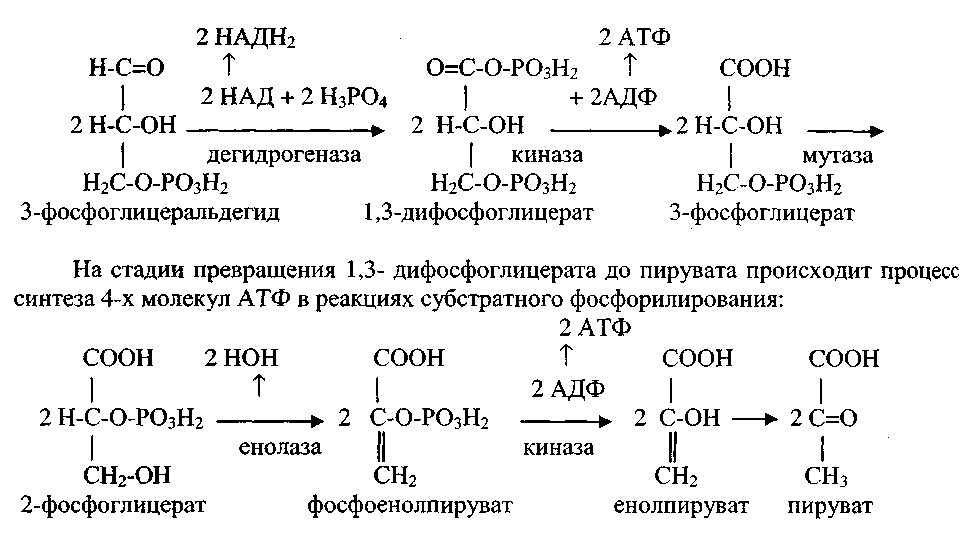Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основным топливом при биологическом окислении является ВОДОРОД.
Известно, что реакция окисления водорода кислородом в газовой среде сопровождается выделением большого количества энергии, сопровождаемым взрывом и пламенем. Эволюция живых организмов привела к тому, что реакция окисления водорода до воды оказалась разделенной на отдельные этапы, что обеспечивает постепенное высвобождение энергии в процессе биологического окисления. При этом часть полученной энергии рассеивается в виде тепла (около 60%) а другая часть (около 40%) аккумулируется в молекулах АТФ. 6)
7) В печени из холестерина образуются желчные кислоты. синтезируется 2,8 – 3,5 г в сутки. играют важную роль в процессах переваривания и всасывания жиров; способствуют росту и функционированию нормальной кишечной микрофлоры. Желчные кислоты — производные холановой кислоты С23Н39СООН, в молекуле которой к кольцевой структуре присоединены гидроксильные группы. Основными Ж. к., обнаруживаемыми в жёлчи (Жёлчь) человека, являются холевая кислота, хенодезоксихолевая кислота и дезоксихолевая кислота.
ЖЕЛЧНЫЕ КИСЛОТЫ, монокарбоновые гидроксикислоты, относящиеся к классу стероидов. Почти все желчные кислоты - производные прир. холановой к-ты (ф-ла Iа). 30 билет. 1) Клиническая химия (также известна как клиническая биохимия или медицинская биохимия) - область клинической лабораторной диагностики, использующая методы аналитической химии для исследования биологических объектов на предмет содержания определенных химических веществ с целью диагностики заболеваний или патологических состояний организма. Медицинская биохимия- раздел биологической химии, изучающий изменение химического состава и обмена веществ в жидких средах, органах и тканях организма человека при различных патологических состояниях. 2) ЗАВИСИМОСТЬ БИОЛОГИЧЕСКИХ ФУНКЦИЙ ОТ СТРУКТУРЫ БЕЛКОВ Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная. Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны-РЕГУЛЯТОРНАЯ, ЗАЩИТНАЯ ФУНКЦИИ. Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо-ТРАНСПОРТНАЯ ФУНКЦИЯ. Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
3)РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ.ИНГИБИТОРЫ И АКТИВАТОРЫ ФЕРМЕНТОВ Активность ферментов в клетке непостоянна во времени. Она чутко реагирует на ситуацию, в которой оказывается клетка, на факторы, воздействующие на клетку как снаружи, так и изнутри. Главная цель этой реакции – отреагировать на изменение окружающей среды, приспособить клетку к новым условиям, дать должный ответ на гормональные и иные стимулы, а в некоторых ситуациях – получить шанс выжить. Основными факторами, от которых зависит активность ферментов в клетке являются: - количество фермента, - локализация ферментов в клетке, - изменения уровня рН, температуры, - количество субстрата, - наличие аллостерических эффекторов: активаторов и ингибиторов, - ограниченный (частичный) протеолиз проферментов. Вещества, повышающие активность ферментов и, следовательно, скорость ферментативной реакции, называются активаторами. Активность ферментов могут повышать ионы металлов, кофакторы ферментов, субстраты. Активация ферментов может осуществляться путем химической модификации структуры фермента, т.е. путем превращения неактивного профермента в фермент, путем присоединения какой-либо специфической модифицирующей группы к молекуле фермента, или путем диссоциации неактивного комплекса на активный фермент и связывающий комплекс. Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Ингибиторы – вещества, снижающие активность фермента. Различают обратимое и необратимое ингибирование ферментов. При определенных условиях при обратимом ингибировании возможно удаление ингибитора и восстановление активности фермента. Обратимое ингибирование бывает двух видов: конкурентное и неконкурентное. При конкурентном обратимом ингибировании ингибитор по своей структуре похож на субстрат, легко соединяется с субстратным центром фермента (контактная, якорная площадка), но не может прореагировать с ним. Некоторые ингибиторы образуют комплекс не со свободным ферментом, а с ферментсубстратным комплексом: ES + I <====> ESI В этих случаях повышение концентрации субстрата не уменьшает действие ингибитора. Такие ингибиторы называются неконкурентными. Витамины – это низкомолекулярные органические соединения, не синтезируемые в организме человека, но, присутствуя в небольших количествах в некоторых продуктах питания, при поступлении в организм обеспечивают нормальный метаболизм и выполнение клетками соответствующих физиологических функций. ^ Классификация витаминов: ^ Роль витаминов в обмене веществ.
|
|||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 293; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.131.13.194 (0.008 с.) |