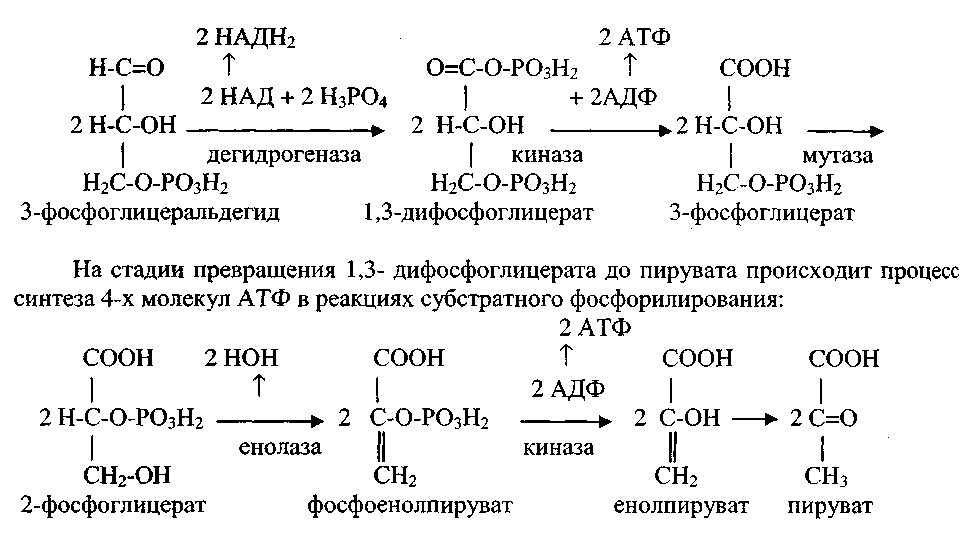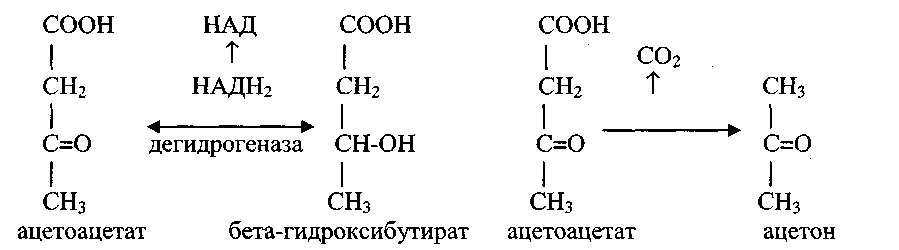Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Состав и функции протеогликановСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Протеогликаны — высокомолекулярные соединения, состоящие из белка (5-10%) и гликозаминогликанов (90-95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани. Протеогликаны состоят из сердцевинных белков с молекулярной массой от 10 до 600 кДа, с которыми ковалентно связаны несколько гликозаминогликановых цепей; Функции протеогликанов: 7)Биохимические основы желчекаменной болезни. Основная функция желчи – участие в переваривании и всасывании липидов. Эту функцию выполняют желчные кислоты, эмульгирующие жиры и таким образом обеспечивающие гидролиз жиров панкреатической липазой. Секреция желчи является также основным путем выведения избытка холестерина из организма. Он выводится как в виде желчных кислот, которые образуются в печени из холестерина, так и в свободном виде. Холестерин – гидрофобное вещество, поэтому в растворенном состоянии в виде мицелл желчи его удерживают желчные кислоты. Соотношение желчных кислот и холестерина должно быть приблизительно 12:1. при уменьшении образования желчи или увеличении количества в желчи холестерина последний выпадает в осадок. Этот густой маслянистый осадок пропитывается солями кальция, желчными пигментами и со временем превращается в камни.При желчекаменной болезни в желчном пузыре или желчных протоках образуются камни в результате осаждения и кристаллизации компонентов желчи-холестерина и билирубина.Обычно в желчных камнях основная масса приходится на холестерин.Образование холестириновых камней как следствие дестабилизации жидкокристаллической формы холестерина,происходит вследствии увеличения количества холестерина в составе желчи и уменьшения синтеза или экскреции желчных кислот.Осаждению холестерина способствует застой желчи,воспалительные заболевания желчного пузыря и протоков.Центрами кристаллизации холестерина могут служить конгломераты белка или слущивающиеся клетки эпителия.Консервативным способом лечения желчекаменной болезни является использование хенодезоксихолевой кислоты,от которой в наибольшейстепени зависит растворимость холестерина.Кроме того,хенодезоксихолевая кислота ингибирует ГМГ-КоА-редуктазу и приостанавливает синтез холестерина.Так при приеме 1г хенодезоксихолевой кислоты в день синтез холестерина ументшается в два раза и его концентрация в желчи уменьшается.В этих условиях не только преращается осаждение холестерина,но становится возможным растворение уже имеющихся камней.
24 bilet 1)Цели и задачи динамической биохимии. Цель динамической биохимии– описать некоторые общие принципы И мотивы метаболизма, процессы обмена конкретных биомолекул, а также Энергетику взаимосвязанных реакций обмена. биохимия динамическая раздел Б., изучающий обмен веществ в организме от момента поступления в него питательных веществ до образования конечных продуктов обмена, механизмы нейтрализации токсических продуктов, выведения их из организма и регуляции скорости соответствующих превращений.
2)изоэлектрическое состояние и изоэлектрическая точка белков Изоэлектрической точкой называют такую концентрацию водородных ионов, т. е. такое значение рН, при котором имеется равновесная концентрация положительных и отрицательных зарядов у белковой молекулы. При изоэлектрической точке молекула белка электронейтральна и не передвигается в электрическом поле. В таком состоянии молекулы белка легко выпадают в осадок, чем и пользуются для разделения белковых веществ при их совместном присутствии. Как видно из табл. 4, большинство белков имеют изоэлектри-чеекую точку при рН от 4,0 до 8,0. Изоэлектрическая точка фермента желудочного сока пепсина находится в резко кислой среде при рН 1,0, а химотрипсина при рН 8,1. При изоэлектрической точке молекула белка электронейтральна и не передвигается в электрическом поле. В таком состоянии молекулы белка легко выпадают в осадок, чем и пользуются для разделения белковых веществ при их совместном присутствии. Как видно из табл. 4, большинство белков имеют изоэлектри-чеекую точку при рН от 4,0 до 8,0. Изоэлектрическая точка фермента желудочного сока пепсина находится в резко кислой среде при рН 1,0, а химотрипсина при рН 8,1. При изоэлектрической точке молекула белка электронейтральна и не передвигается в электрическом поле. В таком состоянии молекулы белка легко выпадают в осадок, чем и пользуются для разделения белковых веществ при их совместном присутствии.Большинство белков имеют изоэлектри-чеекую точку при рН от 4,0 до 8,0. Изоэлектрическая точка фермента желудочного сока пепсина находится в резко кислой среде при рН 1,0, а химотрипсина при рН 8,1. Белковые вещества в водной среде проявляют свойства амфо-терности, т. е. они ведут себя и как кислоты, имея карбоксильные группы, и как основания благодаря наличию аминных групп. Однако если раствор белка подкислять, то его кислотная диссоциация будет подавляться, белок заряжается положительно, образуется катион белка. Если добавлять щелочь, то щелочная диссоциация белка будет подавляться, белок заряжается отрицательно, появится анион белка. Следовательно, поведение белков в электрическом поле будет зависеть от аминокислотного состава их, что и используют для разделения белков на фракции при электрофорезе. Если в белках преобладают аминокислоты, содержащие по две карбоксильные группы (глютаминовая и аспарагиновая кислоты), такие белки в электрическом поле будут передвигаться к аноду (+), а белки, содержащие основные аминокислоты (аргинин, лизин и гистидин), будут передвигаться к катоду (-). Различают электрофорез на гелях — крахмальном, агаровом, полиакриламидном и т. д. В последнее время наиболее часто для разделения белков, содержащихся в биологических жидкостях, применяют сефадексы1, «молекулярные» сита. При этом белковые молекулы отделяются друг от друга в зависимости от величины и их электрического заряда. Для этой цели используют катиониты и аниониты.
3)влияние концентрации субстрата на активность ферментов Влияние концентрации водородных ионов на каталитическую активность ферментов состоит в воздействии ее на активный центр. При разных значениях рН в реакционной среде активный центр может быть слабее или сильнее ионизирован, больше или меньше экранирован соседними с ним фрагментами полипептидной цепи белковой части фермента и т.п. Кроме того, рН среды влияет на степень ионизации субстрата, фермент-субстратного комплекса и продуктов реакции, оказывает большое влияние на состояние фермента, определяя соотношение в нем катионных и анионных центров, что сказывается на третичной структуре белковой молекулы. Последнее обстоятельство заслуживает особого внимания, так как определенная третичная структура белка-фермента необходима для образования фермент-субстратного комплекса.
Специфичность - одно из наиболее выдающихся качеств ферментов. Эго свойство их было открыто еще в прошлом столетии, когда было сделано наблюдение, что очень близкие по структуре вещества - пространственные изомеры (?- и?-метилглюкозиды) расщепляются по эфирной связи двумя совершенно разными ферментами.
Таким образом, ферменты могут различать химические соединения, отличающиеся друг от друга очень незначительными деталями строения, такими, например, как пространственное расположение метоксильного радикала и атома водорода при 1-м углеродном атоме молекулы метилглюкозида. 4)гиповитаминоз в1 причины и последствия
описание. Гиповитаминоз В1 сопровождается нарушением окисления углеводов, накоплением недоокисленных продуктов и снижением синтеза ацетилхолина. Лабораторно при дефиците витамина В1 уровень тиамина в плазме крови менее 14,8 ммоль/л, в суточной моче менее 100 мкг, уровень пировиноградной кислоты в плазме более 0,114 ммоль/л и суточной моче более 30 мг.
Симптомы Гиповитаминоза В1:
Клиническая картина В1-дефицита характеризуется повышенной раздражительностью, плохим сном, рассеянностью, забывчивостью, зябкостью, болями в животе, склонностью к рвоте, дискинезии желудка и кишечника, секреторным расстройствам. К числу ранних симптомов недостатка В1 относят изменения языка. Он становится суховатым, тёмно-красного цвета с маловыраженными сосочками. У детей отчётливо выражены изменения со стороны нервной системы: они капризны, быстро утомляются, жалуются на неопределённые боли по ходу нервов. Сухожильные рефлексы снижены. У маленьких детей нередко наблюдается гиперстезия, плаксивость, плохой сон, угасание рефлексов, общая и частичная скованность.
Причины Гиповитаминоза В1: К числу факторов риска развития гиповитаминоза В1 (тиамина) относят недостаточное употребление продуктов питания с антитиаминными свойствами: рыба семейства карповых, атлантическая сельдь, чай, кофе, брюссельская капуста, красный цикорий, черника, чёрная смородина. На потребность в тиамине существенно влияют степень физической нагрузки, повышенная или пониженная температура окружающей среды; особую группу причин недостаточности тиамина составляют заболевания желудочно-кишечного тракта и печени. В организме человека тиамин не депонируется. При исключении тиамина из рациона питания симптомы недостаточности появляются через 14—21 день. последствия гиповитаминоза При тяжелом авитаминозе B1 развивается болезнь «бери-бери» с поражением нервной системы в виде полиневритов и параличей, формированием сердечно-сосудистой недостаточности, хронических запоров, склонности к отекам. 5)биоэнергетика митохондриального окисления аэробными дегидрогеназами В аэробном гликолизе можно выделить 2 этапа. Подготовительный этап, в ходе которого глюкоза фосфорилируется и расщепляется на две молекулы фосфотриоз. Эта серия реакций протекает с использованием 2 молекул АТФ. Этап, сопряжённый с синтезом АТФ. В результате этой серии реакций фосфотриозы превращаются в пируват. Энергия, высвобождающаяся на этом этапе, используется для синтеза 10 моль АТФ.
2. Реакции аэробного гликолиза
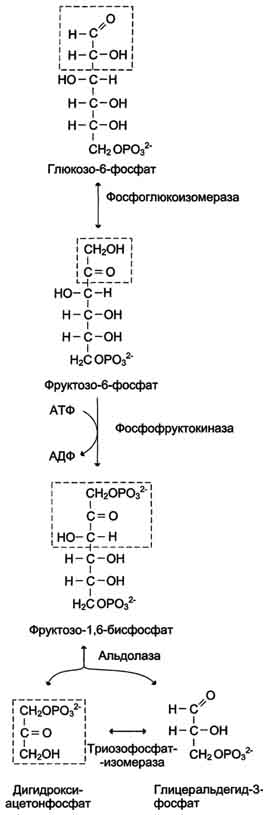
Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата
Глюкозо-6-фосфат, образованный в результате фосфорилирования глюкозы с участием АТФ, в ходе следующей реакции превращается в фруктозо-6-фосфат. Эта обратимая реакция изомеризации протекает под действием фермента глюкозофосфатизомеразы.
Затем следует ещё одна реакция фосфорилирования с использованием фосфатного остатка и энергии АТФ. В ходе этой реакции, катализируемой фосфофруктокиназой, фруктозо-6-фосфат превращается в фруктозо-1,6-бисфосфат. Данная реакция, так же, как гексокиназная, практически необратима, и, кроме того, она наиболее медленная из всех реакций гликолиза. Реакция, катализируемая фосфофруктокиназой, определяет скорость всего гликолиза, поэтому, регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы.
6)метаболиты дихотомического пути катаболизм. м глюкозы Окислительное декарбоксилирование пирувата
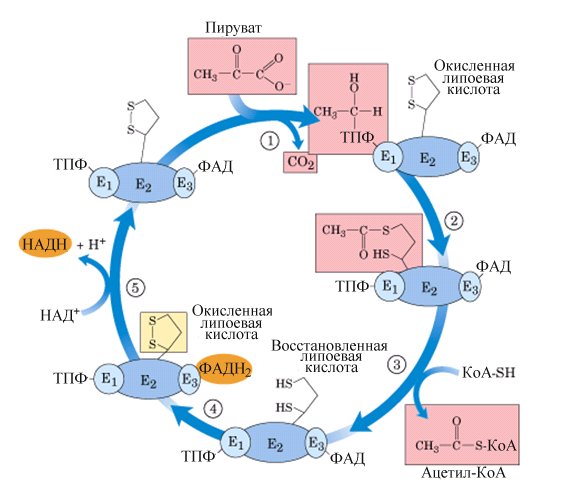
Пируват, образовавшийся в реакциях гликолиза (в цитоплазме), должен быть транспортирован в митохондрии. Транспорт осуществляется специальной «челночной» системой. В матриксе митохондрии, прикрепившись к ее внутренней мембране, находится сложный полиферментный комплекс – пируватдегидрогеназа.
Пируватдегидрогеназа состоит из 60 полипептидных цепей, которые можно разделить на 3 основных фермента: Е1 – собственно пируватдегидрогеназа (состоит из 24 субъединиц); Е2 – дигидролипоилтрансацетилаза (также 24 субъединицы); Е3 – дигидролипоилдегидрогеназа (12 субъединиц).
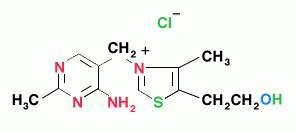
Последовательность реакций представлена на рис.5.12. Е1 катализирует декарбоксилирование ПВК с участием кофермента тиаминпирофосфата (ТПФ). Образовавшийся продукт реакции (гидроксиэтильное производное ТПФ) при участии Е2 реагирует с окисленной липоевой кислотой(ЛК). Липоевая кислота – низкомолекулярное азотсодержащее соединение – является коферментом Е2.
CH2
СН2 СН – (СН2)4 – СООН
S – S
Липоевая кислота
Дисульфидная группа ЛК способна восстанавливаться и ацетилироваться. В реакции, катализируемой дигидролипоилтрансацетилазой (Е2), образуется ацетиллипоевая кислота. Далее это соединение реагирует с коэнзимом А (КоА-SH не является собственным коферментом Е2) – при этом образуется восстановленная форма ЛК (дигидролипоевая кислота) и ацетил-КоА.
Наконец, начинает функционировать Е3, коферментом которого является ФАД: кофермент окисляет дигидролипоевую кислоту и сам при этом восстанавливается (ФАДН2). Восстановленный флавиновый кофермент реагирует с митохондриальным НАД+, в свою очередь, восстанавливая его (НАДН ·Н+).
Таким образом, в окислительном декарбоксилировании ПВК участвует фактически три фермента, составляющих единый пируватдегидрогеназный комплекс, и 5 коферментов: ТПФ, ЛК и ФАД – собственные коферменты комплекса, КоА-SH и НАД+ – внешние, приходящие “извне”. Образующийся ацетил-КоА затем окисляется в цикле Кребса, а водород с НАДН ·Н+ поступает в дыхательную цепь митохондрий
7)биохимические основы атеросклероза Атеросклероз— хроническое заболевание артерий эластического и мышечно-эластического типа, возникающее вследствие нарушения липидного обмена и сопровождающееся отложением холестерина и некоторых фракций липопротеидов в интиме сосудов. Отложения формируются в виде атероматозных бляшек. Последующее разрастание в них соединительной ткани (склероз), и кальциноз стенки сосуда приводят к деформации и сужению просвета вплоть до облитерации (закупорки). Важно различать атеросклероз от артериосклероза Менкеберга, другой формы склеротических поражений артерий, для которой характерно отложение солей кальция в средней оболочке артерий, диффузность поражения (отсутствие бляшек), развитие аневризм (а не закупорки) сосудов. Атеросклероз сосудов ведет к развитию ишемической болезни сердца. Биохимическую основу атеросклероза с оставляет блокада апоВ-100 лиганд-рецепторного взаимодействия и поглощения клетками ЛП низкой плотности (ЛПНП). У человека ЛПНП являются основной транспортной формой эссенциальных поли-ЖК в форме эфиров холестерина (поли-ЭХ), точнее этерифицированных холестерином (Хс) эссенциальных поли-ЖК. Результатом этой блокады является дефицит в клетках эссенциальных поли-ЖК, который и запускает атеросклероз. Чем выше в крови уровень (Хс), точнее, полиеновых эфиров Хс, поли-ЭХ), тем большим является в клетках дефицит эссенциальных ЖК [19]. Многие этиологические факторы [15], которые запускают единые механизмы патогенеза, дают основание рассматривать атеросклероз не как нозологическую форму заболевания, а как синдром. С этих позиций мы и предлагаем рассмотреть взаимоотношение синдрома атеросклероза и синдрома воспаления.
Билет 1) Биохимия — это наука, занимающаяся изучением различных молекул, химических реакций и процессов, протекающих в живых клетках и организмах. Основательное знание биохимии совершенно необходимо для успешного развития двух главных направлений биомедицинских наук: 1) решение проблем сохранения здоровья человека; 2) выяснение причин различных болезней и изыскание путей их эффективного лечения. 2) Биологические мембраны это наиболее распространенная форма белков и липидов, обеспечивающее существование клетки. Мембраны состоят в основном из белков и липидов в наиболее распространенном соотношении этих компонентов 1:1. а миэлиновые мембраны имеют соотношение белки-липиды равное 3:1. В мембранах присутствуют углеводы (до 5%), составляющие углеводную часть гликолипидов и гликопротеинов, и иногда РНК (до 0,1%). Биологические мембраны включают и различные белки: интегральные (пронизывающие мембрану насквозь), полуинтегральные (погруженные одним концом во внешний или внутренний липидный слой), поверхностные (расположенные на внешней или прилегающие к внутренней сторонам мембраны). Функции: барьерная транспортная, механическая, ферментативная, рецепторная, матричная, 3) влияние температуры на скорость ферментативной реакции может быть выражена через температурный коэффицент (Q 10): Q10 = Vt +10/Vt. При каждом повышении температуры на 10 градусов скорость ферментативной реакции удваивается. Температура обеспечивающая наибольшую активность называется оптимальной температурой. За пределами этого уровня вследствии наступающей денатурации фермента, Скорость реакции снижается до нуля. 4) Причиной гиповитаминоза В12 является недостаточное употребление в пищу продуктов содержащих витамин В12. А также причинами могут быть панкреатит, дисбактериоз, врожденные заболевания желудочно-кишечного тракта. Витамин В12 сдержится в пище животного происхождения: печени, почки, молоке, сыр, творог. При недостаточности витамина Б12 нарушается образование ДНК. нарушается функция систем кроветворения. пищеварения, нервной. общее недомогание, слабость, упадок сил, боли в области сердца, ухудшение памяти, забывчивость, депрессия, ухудшение аппетита, боли в животе, понос, запоры. Развиваются гиперхромная макроцитарная (мегалобластическая) анемия, лейкопения и тромбоцитопения. Отмечается развитие фуникулярного миелоза (дегенерация задних и боковых столбов спинного мозга), приводящего к парестезиям, параличам и нарушению функции тазовых органов. Чаще гиповитаминоз встречается у вегетарианцев. 5) 6) пентозный цикл катоболизма глюкозы проходит в 2 фазы: Первая фаза окисление шести молекул глюкозо-6- фосфата и образование 12 молекул НАДН2, 6 молекул углекислого газа, 6 молекул различных фосфопентоз.
Вторая фаза превращения фосфопентоз (рибулозо-5 фосфат, рибозо 5 фосфат, ксилулозо5 фосфат) в транскелотазных рейкций с образованием 5 молекул фруктозо 6 монофосфата и превращение их в глюкозо 6 монофосфат. (стр 122-123 Тапбергенов) 7) Стероиды – широко распространенные в природе соединения. Все стероиды в своей структуре имеют ядро, образованное гидрированным фенантреном (кольца А, В и С) и циклопентаном (кольцо D):
К стероидам относятся, например, гормоны коркового вещества надпочечников, желчные кислоты, витамины группы D, сердечные гликозиды и другие соединения. В организме человека важное место среди стероидов занимают стерины (стеролы), т.е. стероидные спирты. Главным представителем стеринов является холестерин (холестерол). Ввиду сложного строения и асимметрии молекулы стероиды имеют много потенциальных стереоизомеров. Каждое из шестиуглеродных колец (кольца А, В и С) стероидного ядра может принимать две различные пространственные конформации – конформацию «кресла» либо «лодки». В природных стероидах, в том числе и в холестерине, все кольца в форме «кресла» (рис. 6.2), что является более устойчивой конформацией. В свою очередь по отношению друг к другу кольца могут находиться в цис- или транс-положениях. Билет 1)Биохимическая диагностика является одним из главных способов решения экстренных и сложнейших проблем. В тоже время применение новых лекарственных средств и новых методов лечения, проведения сложных хирургических операций требуют постоянного биохимического контроля. Врач не всегда верно подходит к назначению клинико - биохимических анализов, следовательно лечение и диагноз будут неправильными, поэтому знание биологической химии играет очень большую роль в становлении компетентности врача. 2) Физико-химические свойства белков: молекулярная масса, амфотерность, ионизация, гидратация, растворимость, осаждение Ионизация белковых молекул R---CH--(NH2)n R---CH--(NH3+)n | | C=O C=O | | NH NH | + Н2О | . --------->. | | C=O C=O | | NH NH | | R---CH--(COOH)n R---CH--(COO-)n • Ионизация белковых молекул зависит от рН среды. При определенном значении рН число положительно и отрицательно заряженных групп может быть одинаковым. Такое состояние белковой молекулы называется изоэлектрическим состоянием (суммарный заряд молекулы белка равен нулю). Значение рН при котором белок находится в изоэлектрическом состоянии, называют изоэлектрической точкой (рI). Диссоциация ионогенных групп приводя к появлению заряда у молекулы белка, обеспечивает дополнительную фиксацию дипольных молекул воды в гидратной оболочке:
- H H- >О++ -OOC---|_________|--NH3+ >О++ - H H - | protein | H - H - ++ О< - + 3HN---| |--COO- ++ О< H - |_________| H – 3) Клетка является следствием структурного и функционального кооперирования различных мембранных образований, к которым относятся ядро, цитозоль, митохондрии, аппарат Гольджи, эндоплазматический ретикулум, пероксисомы и лизосомы-микротельца разного типа. Каждое из этих мембранных образований имеет существенные структурные особенности и выполняет специфические функции в клетке, но все они построены по единому типу. Эндоплазматический ретикулум (ЭПР) представляет собой систему уплощенных мембранных мешочков, канальцев, цистерн, пузырьков. Выделяют два типа ЭПР: гранулярный (шероховатый) и агранулярный (гладкий). Функции способность синтезировать интегральные и периферические белки мембран, липидный компонент мембран и осуществлять сборку липопротеидных мембран. Аппарат Гольджи Функции. 1. Секреторная Мембранные элементы аппарата Гольджи участвуют в сегрегации и накоплении продуктов, синтезированных в ЭПР, участвуют в их химических перестройках, созревании; Лизосомы. Представляют собой пузырьки, ограниченные одиночной мембраной с разнородным содержимым внутри. Все лисосомы содержат ферменты гидролазы, что позволяет им участвовать в процессах внутриклеточного переваривания. Функции Митохондрии осуществляют синтез АТФ, происходящий в результате процессов окисления органических субстратов и фосфорилирования АДФ Незаменимые жирные кислоты («витамин F») — комплекс полиненасыщенных жирных кислот, которые принимают значительное участие в метаболизме животных. Разделяют два семейства полиненасыщенных жирных кислот: омега-3 и омега-6. Организм способен преобразовывать кислоты одного класса в другой, но не способен синтезировать оба класса из более простых веществ. Омега-3-ненасыщенные жирные кислоты: линоленовая кислота, эйкозапентаеновая кислота, докозагексаеновая кислота. Омега-6: арахидоновая кислота Линолевая кислота. Природными источниками витамина F являются растительные масла из завязи пшеницы, семени льна, рыжиковое масло, горчичное масло, масло подсолнечника, соевых бобов, арахиса, а также грецкий орех, миндаль, семечки подсолнуха, рыбий жир и рыба жирных и полужирных видов (лосось, макрель, сельдь, сардины, форель, тунец и др.) и моллюски. 5) некоторые вещества разобщают окисление и фосфолирирование. Например 2,4- динитрофенол (стр 212 Николаев формула) это лирофильное вещество легко диффундирует через митохондриальную мембрану как в ионизированной, так и в неионизированной форме и может переносить ионы водорода через мембрану в сторону их меньшей концентрации. Поэтому 2,4 динитрофенол уничтожает ∆мН+ митохондриальной мембраны, а энергия рассеивается в форме теплоты. Потребление кислорода и окисление субстратов при этом продолжается, но синтез АТФ невозможен. Поскольку энергия при разобщении рассеивается в форме теплоты, то разобщители повышают температуру тела (пирогенное действие). • 6) Основной путь катаболизма глюкозы у аэробных организмов, к которым относится и человек, - это аэробный распад, конечным продутом которого является вода и углекислый газ.Разрушение глюкозы дихотомическим путем в аэробных условиях (аэробный гликолиз) до стадии образования пирувата - это специфические стадии катаболизма глюкозы, которые, в отличие от общих путей катаболизма, происходят в цитозоле
7) Синтез кетоновых тел • К кетоновым телам относятся ацетоацетат и бета-гидроксибутират (ацетоуксусная и бета-оксимаслянная кислоты). Синтез кетоновых тел имеет место только в печени, в других органах он не идет. Синтез кетоновых тел начинается с образования ацетоацетил-КоА из двух молекул ацетил-КоА при участии ацетил-КоА-ацетилтрансферазы: СН3 • СН3 СН3 НS-КоА | • | | С=О • С=О + С=О | • \ \ ацетилтрансфераза СН2 • S-КоА S-КоА | • ацетил-КоА ацетил-КоА С=О \ S-КоА ацетоацетил-КоА
В сердечной мышце ацетоацетат обменивается с сукцинил-КоА на НS-КоА и, образующиеся ацетоацетил-КоА и сукцинат включаются в общие пути катаболизма как непосредственные источники энергии
В норме в крови уровень кетоновых тел 0,1-0,6 ммоль/л Билет 1) 2) Генетический код для аминокислот является вырожденным. Это означает, что значительное большинство аминокислот кодируется несколькими кодонами. За исключением метионина и триптофана, Узнавание кодона мРНК антикодоном тРНК основано не только на спаривании оснований, когда каждое основание кодона образует пару оснований с комплементарным азотистым основанием антикодона. В этом случае каждый антикодон, соответственно каждая молекула тРНК, может в принципе узнавать только один кодон мРНК. Вырожденность генетического кода имеет биологический смысл, обеспечивая организму ряд преимуществ. В частности, она способствует «совершенствованию» генома, так как в процессе точечной мутации, вызванной химическими или физическими факторами, возможны различные аминокислотные замены. Другой отличительной особенностью генетического кода является его непрерывность, отсутствие «знаков препинания», т.е. сигналов, указывающих на конец одного кодона и начало другого. Другими словами, код является линейным, однонаправленным и непрерывающимся: АЦГУЦГАЦЦ. Это свойство генетического кода обеспечивает синтез точной и в высшей степени упорядоченной последовательности аминокислотных остатков в молекуле белка. 3) Лактатдегидрогеназа (ЛДГ) – фермент, обратимо катализирующий окисление лактата в пируват. Известны 5 изоформ ЛДГ, из них большее диагностическое значение имеют ЛДГ1 и ЛДГ5. ЛДГ1 участвует в окислении лактата в пируват и преобладает в тканях с аэробным типом метаболизма (миокард, почки, мозг, эритроциты, тромбоциты). ЛДГ5 напротив, способствует превращению пирувата в лактат и активна в тканях с высоким уровнем гликолиза (печень, скелетные мышцы). Основная роль общей ЛДГ заключается в выявлении тканевого повреждения. Выявлена высокая специфическая активность для печени, миокарда, скелетной мускулатуры, почек и эритроцитов. При мышечной дистрофии Дюшенна увеличение активности ЛДГ выявляется за несколько лет до обнаружения клинических сиптомов. Определение активности изоферментов ЛДГ1 более информативно при заболеваниях крови, почек, миокарда, а ЛДГ5 – при заболеваниях гепатобилиарной системы. Активность ЛДГ также повышается при циррозе, опухолях различной локализации, травмах, лекарственной интоксикации 4) Биоти́н — водорастворимый витамин группы В. Молекула биотина состоит из тетрагидроимидазольного и тетрагидротиофенового кольца, в тетрагидротиофеновом кольце один из атомов водорода замещен на валериановую кислоту. содержится в говядине, телятине, курином мясе и ветчине, коровьем молоке и сыре, сельди. Из растительных продуктов им богаты помидоры, соевые бобы, неочищенный рис и рисовые отруби, пшеничная мука, морковь и цветная капуста, яблоки и апельсины, бананы и дыня, картофель, свежий лук, цельные зёрна ржи. В тканях животных биотин связан с белками, а во фруктах и овощах он содержится в свободном состоянии. Биотин занимает важную роль в процессах обмена белков, жиров и углеводов, необходим для активации витамина С, с его участием протекают реакции активирования и переноса углекислого газа в кровеносной системе, формирует часть некоторых ферментных комплексов и необходим для нормализации роста и функций организма. Биотин, взаимодействуя с гормоном инсулином, стабилизирует содержание сахара в крови, также участвует в производстве глюкокиназы. Оба этих фактора важны при диабете. Рекомендуемой суточной дозой биотина является: для взрослых 150-300 мкг для детей, в зависимости от возраста и пола 50-150 мкг
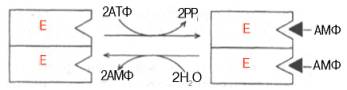
5) АТФ – это универсальное энергетическое вещество организма. АТФ – нуклеотид, в состав молекулы которого входят азотистое основание – аденин, углевод – рибоза и три остатка фосфорной кислоты. Особенностью молекулы АТФ является то, что второй и третий остатки фосфорной кислоты присоединяются связью, богатой энергией, иначе называемой макроэргической связью. Часто соединения, имеющие макроэргическую связь (а мы столкнемся с ними в процессе изучения предмета) обозначатся термином «макроэрги» или макроэргические вещества. Строение АТФ: ^ Аденин – рибоза – Ф.К. – Ф.К. – Ф.К. аденозин
При использовании АТФ в качестве источника энергии обычно происходит отщепление путем гидролиза последнего остатка фосфорной кислоты. ^ АТФ + Н2О → АДФ + Н3РО4 + энергия Главными потребителями энергии АТФ в организме являются реакции синтеза; мышечная деятельность; транспорт молекул и ионов через мембраны 6)
7 При смешанной диете примерно половина суточной нормы холестерина синтезируется в кишечнике, коже и главным образом в печени (примерно 50%), а остальной холестерин поступает с пищей. Значительная часть холестерина включена в липидный слой плазматических мембран. Большое количество холестерина расходуется в биосинтезе желчных кислот (см. с. 306), часть выделяется с желчью. Ежесуточно из организма выводится примерно 1 г холестерина. Очень небольшая часть холестерина используется для биосинтеза стероидных гормонов Главным источником для синтеза холестерина является ацетил-КоА, и до стадии образования b-гидрокси-b-метилглутарил-КоА (ГМГ-КоА)
Под воздействием мевалонат киназы с использованием двух молекул АТФ образуется мевалонилпирофосфат, при декарбоксилировании которого образуется изопентилпирофосфат и далее диметилаллилпирофосфат:
22 билет
|
||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 972; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.2 (0.012 с.) |