Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологическая роль пентозофосфатного пути катаболизма глюкозы.Содержание книги
Поиск на нашем сайте Этот путь катаболизма широко представлен в различных тканях человека и животных (печень, надпочечники, лимфотические узлы, эритроциты, жировая ткань и др.). Ключевым ферментом апотомического пути является глюкозо-6-фосфатдегидрогеназа, впервые обнаруженная О.Варбургом в эритроцитах. В этом пути катаболизма образуются различные фосфопентозы как промежуточные метаболиты и поэтому его называют пентозофосфатным циклом. Путь прямого окисления глюкозо-6-монофосфата в основном протекает в цитозоле без участия кислорода: 6(глюкозо-6-фосфат)+12НАДФ+7НОН 5(глюкозо-6-фосфат)+6СО2+12НАДФН2+Н3РО4 В аэробных условиях процесс продолжается с участием ферментов дыхательной цепи митохондрий: 12 НАДФН2 + 6 (О2) 12 НАДФ + 12 НОН + ΔG(36АТФ) Биологическая роль пентозного цикла состоит в следующем: 1. В этом пути при окислении одной молекулы глюкозо-6-фосфата образуется 12 НАДФН2, которые используются клетками для синтеза жирных кислот, стероидных гормонов, для обезвреживания ядов и др. 2. В этом процессе синтезируются различные пентозы, в том числе рибоза, необходимая для построения молекул нуклеотидов и нуклеиновых кислот. 3. В аэробных условиях, при переносе протонов и электронов с цитозольных 12 молекул НАДФН2 в митохондрии на ферменты дыхательной цепи, возможен синтез 36 молекул АТФ в реакциях окислительного фосфорилирования. Пентозофосфатный путь катаболизма углеводов активен прежде всего, в тех органах и тканях, в который требуется интенсивное использование НАДФН2 в реакциях восстановительных синтезов, использование рибозо-5-фосфата для синтеза нуклеотидов и нуклеиновых кислот. Поэтому высока активность этого пути в жировой ткани, печени, надпочечниках, половых железах, костном мозге, лимфоидной ткани и молочных железах. Относительно активен этот путь в эритроцитах и мало активен в мышечной ткани. Особое значение имеет пентозный цикл в растительных клетках, где основные реакции фотосинтеза по их механизму и фазности напоминают гексозомонофосфатный путь
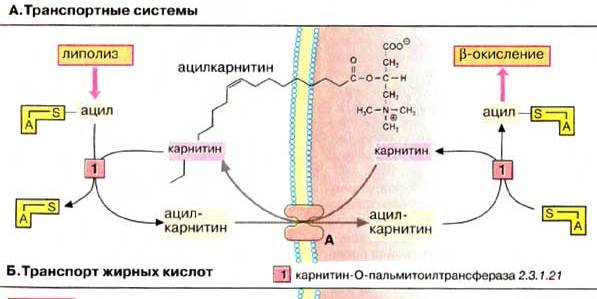
Карнитиновый челночный механизм транспорта жирных кислот в митохондрии В митохондриях за перенос жирных кислот отвечает специальная транспортная система. Активированные жирные кислоты в форме ацил-КоА становятся транспортабельными в цитоплазме после взаимодействия с карнитином. Образовавшийся ацилкарнитин транспортируется в матриксе карнитиновым переносчиком, обмениваясь на свободный карнитин. В матриксе ацильные остатки вновь связываются с КоА.\
Билет
Биохимические принципы, подходы и методы позволили в определенной мере расшифровать основные закономерности функциональной организации биосистем. Благодаря биохимии стали объяснимы такие свойства живых систем как: · сложность структурной организации; · питание и обмен веществ; · дыхание; · наследственность и изменчивость; · многообразие форм и видов; · рост и развитие; · способность извлекать и преобразовывать энергию; · способность к сохранению структурно-функциональной целостности организма; · активное, незавизимое передвижение в пространстве; · самовоспроизводство себе подобных; · приспособляемость; · раздражимость. Все свойства живых систем имеют материальную основу, которая определяется, формируется и функционирует благодаря структурной организации химических соединений в клетку. КЛЕТКА
ОРГАНЕЛЛЫ: белки....аминокислоты НК....нуклеотиды липиды.....жирные к-ты и глицирин полисахариды.....моносахариды
Вся информация о человеке хранится в хромасомах. Хромосомы по своей химической природе являются нуклеопротеодами. Нуклеопротеиды состоят из белковой части (гистоны, протамины) и простетической группы (НК).Высокополимерные ДНК в комплексе с молекулами белков и составляют хромасому. Молекула ДНК за счет остатков фосфорной кислоты заряжается отрицательно и присоединяет к своей поверхности положительно заряженные белки, образую сложный белок дезоксирибонуклеопротеид называемый хроматином. Спираль ДНК соединяется с группами из 8 молекул гистона и образует нуклеосомы — частицы, имеющие вид нанизанных на нитку бусинок. Эти нуклеосом и соединяющие их участки ДНК плотно упакованы в виде спирали толщиной в 36 нм. На каждый виток спирали приходится примерно 6 нуклеосом, которые по своим размерам и другим признакам соответствуют хромомере хромосом. Все хромосомы состоят из двух хромомер и соеденены друг с другом центральными двумя нитями ДНК. Функции хромосом заключается: В хранении наследственной информации. Хромосомы являются носителями генетической информации. Сформулированы основные принципы структурной организации рибосомы: 1) рибосома построена из двух неравных субчастиц; 2) высокополимерная РНК каждой рибосомной субчастицы компактно свернута специфическим образом, формируя структурное ядро рибосомной субчастицы; 3) разнообразные рибосомные белки собраны на ядре РНК как на каркасе, так что каждый белок узнает свою посадочную площадку. Рибосомы представляют собой субклеточные частицы с козффициенто седиментации 80S и молекулярной массой 4,5 млн. Они состоят из двух субъединиц — большой (60S) и малой (40S). Каждая из субъединиц содержит РНК и белки. Функции рибосом: синтез белков.
2 класс ферментов — трансферазы. Ферменты этого класса катализируют перенос функциональных групп и делятся по этому принципу на 8 подклассов:
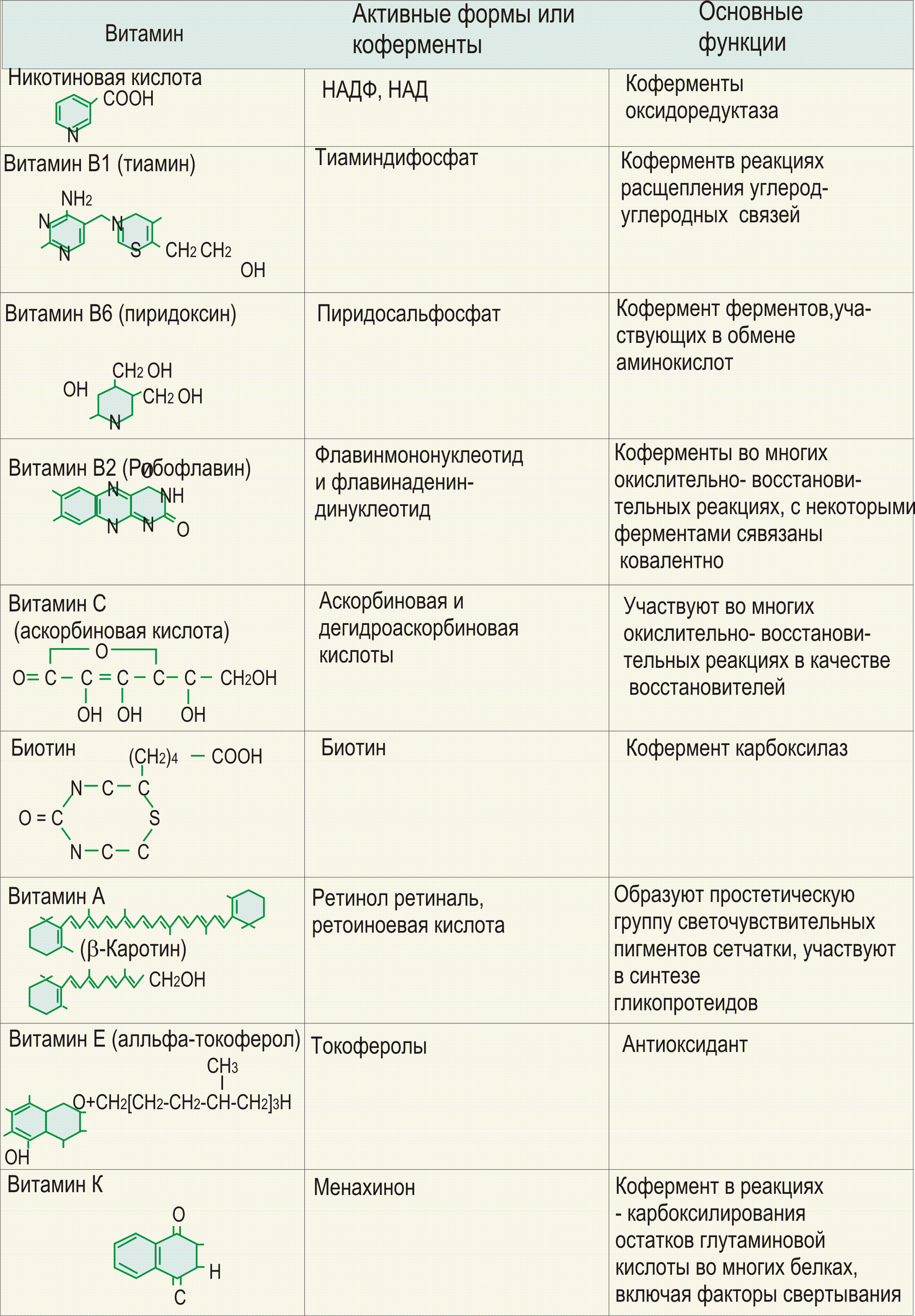
Витамин PP существует в двух формах - никотиновой кислоты и никотиномида. Источники Говяжья печень, дрожжи, брокколи, морковь, сыр, кукурузная мука, листья одуванчика, финики, яйца, рыба, молоко, арахис, свинина, картофель, помидоры, проростки пшеницы, продукты из цельных злаков. Травы, богатые витамином PP: люцерна, корень лопуха, котовник кошачий, кайенский перец, ромашка, песчанка, очанка, семя фенхеля, пажитник сенной, женьшень, хмель, хвощ, коровяк, крапива, овес, петрушка, мята перечная, листья малины, красный клевер, плоды шиповника, шалфей, щавель. Действие Активное воздействие витамина PP на обменные процессы обусловлено его вхождением в состав ниацинамидадениндинуклеотида (НАД) и ниацинамидадениндинуклеотида фосфата (НАДФ), являющихся кофакторами ряда ферментов. В частности, ниацинамид входит в состав кодегидраз, являющихся переносчиками водорода к флавопротеиновым ферментам, и тем самым регулирует окислительно-восстановительные процессы в организме.
ОКИСЛИТЕЛЬНОЕ ФОСФОРИЛИРОВАНИЕ, синтез АТФ из аденозиндифосфата и неорг. фосфата, осуществляющийся в живых клетках, благодаря энергии, выделяющейся при окислении орг. в-в в процессе клеточного дыхания. В общем виде окислительное фосфорилирование и его место в обмене в-в можно представить схемой:
В молекуле АДФ только одна высокоэнергетическая связь, в результате синтеза АТФ путем окислительного фосфорилирования добавляется еще одна, т.е. Энергия окисления субстрата трансформируется в энергию химических связей в молекуле АТФ. Т.е. Главный путь синтеза АТФ из АДФ — окислительное фосфорилирование, при этом Адф фосфорилируется неорганическим фосфатом: АДФ + Н3 РО4 + энергия --- АТФ + Н2 О Синтез АТФ осуществляется на уроне трех участков дыхательной цепи митохондрий, где имеется достаточной величины разность редокс-потенциалов. Первый участок м/у НАД и ФМН (0,21в), второй — м/у b и c (0,22в), третий м/у цитохромоксидазой(а+а3) и кислородом (0,29в). Для качественной оценки был введен покзатель окислительного фосфолирирования- коэффициент Р/0 — отношение количества молекул фосфорной кислоты к количеству атомов кислорода использованных митоондриями при окислении какого-либо субстрата. Другим показателем, характеризующим активность митохондрий в 3-м состоянии, является коэффициент АДФ/О. Величина АДФ/О характеризует функциональную организацию механизмов, определяющих процесс фосфорилирования АДФ в митохондриальной мембране и связь их с активностью терминальной дыхательной цепи. Чем больше величина АДФ/О, тем меньше затрачивается кислорода на фосфорилирование, тем соответственно выше коэффициент полезного действия митохондрий с точки зрения запасания энергии для дальнейших внутриклеточных метаболических процессов.
Значительная часть глюкозы, поступающей в клетки при пищеварении, превращается в гликоген — запасной полисахарид, используемый в интервалах м/у приемами пищи. Синтез осуществляется во всех клетках организма,но особенно активно потекает в скелетных мышцах и печени. Ключевым ферментом синтеза гикогена является активная форма — гликогенсинтетаза «а», которая цАМФ зависимой протеинкиназой переводит ее в неактивную форму — гликогенсинтетазу «b». Гликоген по строению сходен с крахмалом. Непосредственным донором глюкозных остатков при биосинтезе гликогена служит УДФ-глюкоза, которая образуется из УТФ и глюкозо-1-фосфата под воздействием фермента глюкозо-1-фосфат-уридил-трансферазы: глюкозо-у-фосфат + УТФ —УДФ-глюкоза + Н3РО4 Под воздействием гликогенсинтетазы (1,4-гликозилтрансферазы) происходит перенос остатков глюкозы с УДФ-глюкозы на олигосахаридный фермент (гликоген-затравка). Врезультате синтезируется линейная цепь гликогена, остатки глюкозы соеденены друг с другом 1-4 альфа-гликозидной связью: УДФ-глюкоза + n(глюкоза)--- УДФ + 1,4-гликоген Ветвления в молекуле гликогена возникают в результате действия фермента ветвления — амило-1,4-->1,6 гликозилтрансферазы, который переносит фрагмент (олигосахарид) из 5-7 мономеров от 1,4-гликогена и присоединяет его к центру оставшейся линейной цепи гликогена 1,6- гликозидной связью: (1,4)-гликоген ----- 1,4-1,6-гликоген РОЛЬ: необходимость превращения глюкозы в гликоген при запасании энергетического материала обусловлена тем, что накопление легкорастворимой глюкозы в клетках могло бы привести к осмотическому шоку- разрушению клеточной мембраны.
Главными резервными липидами явл. триацилглицириды, депонируемые в липоцитах жировой ткани. Резервирование липидов в ировой ткани идет за счет использования жирных кислот, освобождаемх при разрушении хиломикронов, или доставляемых альбуминами плазмы крови из других тканей. Поскольку в жировой ткани очень низка активность фосфоглицираткиназы, фермента активируещего глицирин, то фактически использование глицирина для синтеза липидов становиься невозможным. Вследствие этого, избыточное употребление в пищу углеводов может ускорить синтез жиров в жировой ткани. Следовательно одной из ричин избыточного отложения жира в жировых депо является не ирная пища, а углеводы. Резервированию жиров в жировых депо способствует гормон поджелудочной железы инсулин. При снижении уроня глюкозы в крови резервирование прекращается и включается процесс мобилизации. Мобилизация наблюдается при длительных физичеких нагрузках, адаптации к холоду, стресс. Мобилизация запускается активацией адреналином гормон чувствительной триацилглицеринлипазы.тот фермент находится в клетках жировой ткани в неактивном виде и активируется через аденилатциклазный каскадный механизм. Пусковым фактором явл.выброс адреналина, который связывается с адренорецепторами активирует аденилатциклазу, фермент синтезиующий 3'5'АМФ изАТФ.
Билет
Биологическая химия (биохимия) - наука, предметом изучения которой являются химический (молекулярный) состав живых организмов и химические (биохимические) реакции, которые происходят в этих организмах и лежащих в основе их жизнедеятельности, то есть выполнение разнообразных физиологических функций. Раздел, изучающий химический состав живых организмов и свойства химических соединений, выделенных из живых тканей, называется статической биохимией. Все многообразие химических реакций в организме, их взаимосвязь и регуляция, а также сопряженные с ними превращения энергии в процессах жизнедеятельности изучаются динамической биохимией. Биохимические процессы, лежащие в основе жизнедеятельности отдельных тканей и органов и проявления их специфической функции, рассматриваются различными разделами функциональной биохимии.
Генети́ческий код — свойственный всем живым организмам способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов. В ДНК используется четыре азотистых основания — аденин (А), гуанин (G), цитозин (С), тимин (T), которые в русскоязычной литературе обозначаются буквами А, Г, Ц и Т. Эти буквы составляют алфавит генетического кода. В РНК используются те же нуклеотиды, за исключением тимина, который заменён похожим нуклеотидом — урацилом, который обозначается буквой U(У в русскоязычной литературе). В молекулах ДНК и РНК нуклеотиды выстраиваются в цепочки и, таким образом, получаются последовательности генетических букв.
Антикодон - участок молекулы транспортной РНК, состоящий из трех нуклеотидов, комплементарно связывающийся с кодоном информационной РНК, что обеспечивает правильную расстановку каждой аминокислоты при биосинтезе белка.
|
||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 4634; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.011 с.) |