Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Клинико-биохимические синдромыСодержание книги
Поиск на нашем сайте
Патология печени Функции печени
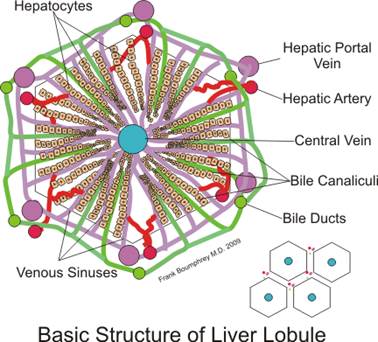
В реализации этих функций ключевая роль принадлежит гепатоцитам, которые входят в состав структурно-функциональных элементов печени – печеночных долек. Кровоснабжается печень преимущественно из бассейна воротной вены и только на 20% - из печеночной артерии. В печеночных дольках берут начало желчные протоки. По ним желчь поступает в систему наружных желчных путей, а затем в кишечник для участия в процессах пищеварения. Печень состоит из двух долей: правой и левой. В правой доле выделяют ещё две вторичные доли: квадратную и хвостатую. Паренхима печени дольчатая. Печёночнaя долька является структурно-функциональной единицей печени
Схема строения печёночной дольки Этиология Разнообразие функций печени во многом определяют особенности возникновения и проявлений болезней этого органа. В силу главенствующей роли печени в процессах обезвреживания чужеродных веществ наиболее частыми причинами патологии печени являются токсические поражения и инфекция. При хроническом воздействии на печень различных патогенных факторов в органе часто развивается прогрессирующий и плохо поддающийся лечению фиброз. Печень обладает уникально высокой способностью гепатоцитов к регенерации после острого повреждения, но эта способность утрачивается в присутствии вирусной инфекции или хронического воспаления печеночной ткани. В печени редко возникают первичные злокачественные опухоли (гепатомы), но зато в этом органе часто выявляются метастазы рака из органов бассейна воротной вены. Болезни печени бывают первичными (наследственными, врожденными) и вторичными (приобретенными). Для практической фармации наибольшее значение имеют заболевания печени, приобретенные в процессе индивидуального развития. Патологию печени вызывают биологические, химические и физические этиологические факторы, а также ей способствуют неблагоприятные внутренние и внешние условия. Среди биологических факторов повреждения гепатоцитов наибольшее значение имеют: РНК- и ДНК-содержащие вирусы;бактерии:стрептококки, стафилококки, сальмонеллы, палочки Коха; паразиты: эхинококки, амёбы, лямблии и другие. Химические повреждения печени вызывают лекарства: противоопухолевые препараты, барбитураты, антибиотики, вакцины, противотуберкулезные препараты, сульфаниламиды, особенно при их длительном применении, а также гепатотропные яды. Печень часто повреждается при тяжелой механической травме. Патология печени возникает не только вследствие прямых повреждений гепатоцитов, но и опосредованно, в результате острых или хронических нарушений кровообращения (тяжелый шок, хроническая сердечная недостаточность и др.), неполноценного питания (недостаток незаменимых аминокислот, ненасыщенных жирных кислот, витаминов, избыток животных жиров и углеводов), других нарушений исполнительных и регуляторных систем. Патогенез По клиническому течению патология печени бывает острой и хронической, она носит очаговый или диффузный характер повреждения. Нарушения печеночных функций могут полностью компенсироваться, а потому длительно не проявляться или не компенсироваться, они бывают обратимыми или носят необратимый характер. Патологические процессы в печени протекают преимущественно в виде воспаления, дистрофии, холестаза, цитолиза, печёночно-клеточной недостаточности. В зависимости от тяжести и распространенности повреждения печеночных клеток возникают различные нарушения обмена углеводов, липидов, белков, ферментов, гормонов, витаминов, а также других печеночных функций. Заболевания печени проявляются в виде клинико-лабораторных симптомокомплексов – синдромов, в основе которых лежат различные формы печеночной недостаточности. Печеночная недостаточность (ПН) характеризуется снижением одной, нескольких или всех функций печени ниже уровня, необходимого для обеспечения нормальной жизнедеятельности организма. Наиболее тяжело протекает острая печёночная недостаточность (ОПН). К развитию ОПН чаще всего приводят вирусные и лекарственные поражения печени. При ОПН, прежде всего, подавляется синтез белков крови (альбуминов), а также нарушается выработка факторов системы свертывания крови. Печеночная недостаточность по числу нарушенных функций бывает парциальная (одна), субтотальная (несколько) и тотальная (все). По течению ПН подразделяют на острую и хроническую, а по исходу заболевания - на летальную и нелетальную. Общий патогенез. Под действием повреждающих факторов (инфекционных или неинфекционных) происходит изменение молекулярной архитектоники мембран гепатоцитов и усиление в клетках процессов перекисного окисления белков и липидов (ПОЛ). Продукты перекисного окисления липидов (гидроперекиси, гидроксильные радикалы и др.) вызывают деструкцию клеточных мембран и повышение их проницаемости. Высвобождение лизосомальных ферментов (гидролаз) приводит к дополнительной деструкции клеток. Продукты распада клеток подвергаются фагоцитозу, а выделяемые при этом макрофагами цитокины (ФНО, ИЛ-1 и др.) способствуют развитию воспалительной реакции в печени. Изменение антигенных свойств поврежденных гепатоцитов приводит к включению в процесс механизмов иммунного воспаления, а также к образованию аутоантител и аутосенсибилизированных T-лимфоцитов (киллеров) к печеночным клеткам. Каждое из перечисленных патогенетических звеньев на определенной стадии развития печеночной недостаточности может стать доминирующим в развитии повреждений печеночных функций. Нарушения углеводного обмена. При патологии печени снижается способность гепатоцитов извлекать избыток глюкозы из крови и превращать ее в гликоген и наоборот - расщеплять гликоген до глюкозы при увеличении потребности органов и тканей в сахаре. Поэтому концентрация глюкозы в крови становиться неустойчивой. При повреждении рецепторных и внутриклеточных механизмов транспорта углеводов в клетках печени нарушается толерантность к глюкозе, а ее концентрация в крови может становиться повышенной - развиваться гипергликемия. При тяжелом молниеносном гепатите и на конечных стадиях цирроза вследствие истощения резервов гликогена в печени или блокирования мобилизации глюкозы из гликогена глюкагоном концентрация сахара в крови снижается – возникает гипогликемия. Нарушения жирового обмена при патологии печени характеризуются снижением способности гепатоцитов превращать атерогенную форму холестерина (свободный холестерин) в менее атерогенный холестерин и образовывать фосфолипиды, обладающие антиатерогенным действием. Такое соотношение липидов в плазме (дислипидемия) способствует отложению холестерина в стенках сосудов и развитию атеросклероза. Нарушения белкового обмена проявляются снижением синтеза гепатоцитами альбуминов, что ведет к уменьшению концентрации белков плазмы, снижению онкотического давления крови и развитию отеков. Нарушение синтеза прокоагулянтов (фибриногена, протромбина, факторов V, VII, IХ-XIII, а также ингибиторов активаторов свертывания и фибринолиза) приводит к развитию коагулопатий, характеризующихся склонностью к кровоточивости. Нарушению свертывания крови способствует уменьшение образование желчи и обусловленная этим задержка всасывания в кишечнике витамина K. В результате нарушения процессов дезаминирования аминокислот и синтеза мочевины происходит снижение в крови содержания мочевины и увеличение токсических субстратов (аммиака). При повреждении гепатоцитов наблюдается уменьшение продукции холинэстеразы и других ферментов, а также увеличение концентрации в крови внутриклеточных печеночных ферментов - аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ). Расстройство обмена витаминов обусловлено нарушением их всасывания (А,D,E,K) из кишечника вследствие дефицита желчи, а также уменьшением способности гепатоцитов превращать провитамины в активные формы (например, каротин в витамин A) и торможением процессов образования коферментов из витаминов (например, из пантотеновой кислоты - ацетил коэнзим A, из витамина B1 - кокарбоксилазы пирувата). С этим связано появление эндогенного (печеночного) гиповитаминоза одного из постоянных спутников печеночной недостаточности. Нарушение антитоксической ("барьерной") функции печени вызывется снижением способности гепатоцитов обезвреживать токсические соединения, образующиеся в кишечнике (фенола, индола, скатола, биогенных аминов, аммиака), а также метаболиты (низкомолекулярных жирных кислот, серосодержащих аминокислот и других соединений) и экзогенные яды (грибов, микробов, паразитов, ядохимикаты). Нарушения метаболизма гормонов. При хронических болезнях печени метаболизм эстрогенов и тестостерона часто нарушается. У мужчин с циррозом печени (особенно алкогольным) интенсивность превращений тестостерона и андростендиона в печени уменьшается, в результате чего стероидные соединения в периферических тканях превращаются в эстрадиол и эстрон. Клинически у мужчин это проявляется гинекомастией, атрофией яичек и половой дисфункцией. Нарушение процессов биотрансформации в гепатоцитах приводит к образованию токсических метаболитов и иммуногенных белков. Токсические метаболиты обезвреживаются путем их вступления в реакцию с глютатионом. При глютатионовой недостаточности, вызванной действием алкоголя или лекарств, происходит увеличение концентрации электрофильных токсических метаболитов и образование комплексов белок-ксенобиотик, которые являются мишенью для клеток иммунной системы и печеночных повреждений. Снижение активности микросомальных ферментов приводит к замедлению инактивации и элиминации противовоспалительных и противосудорожных средств, транквилизаторов, кардиотропных препаратов, а также антибиотиков. Например, в результате нарушения метаболизма парацетамола образуется сильнодействующий свободный радикал (N-ацетилимидохинон), который может необратимо инактивировать многие ферменты и другие белки. При патологии печени В зависимости от характера патологического процесса в печени выделяют несколько клинико-биохимических синдромов, которые характеризуют основные морфологические и функциональные нарушения в органе. Мезенхимально–воспалительный синдром формируется после патогенного воздействия и развития в печени иммунного воспаления. Он характеризуется активацией и пролиферацией лимфоцитов, ретикулогистиоцитарных клеток, а также миграцией лейкоцитов в печеночные дольки. Происходит клеточная инфильтрация портальных протоков и внутридольковой стромы, развивается васкулит. Возникает некроз гепатоцитов и происходит разрастание фиброзной ткани. В крови увеличивается концентрация белков острой фазы воспаления (фибриноген, СРБ), появляются неспецифические антитела и другие биохимические признаки воспаления. Дистрофический синдром обычно развивается при токсическом поражении печени (пищевая интоксикация, инсектициды, суррогаты алкоголя, некоторые лекарства и др.). В генезе развития синдрома важное место занимают иммунопатологические, в том числе аутоаллергические процессы. Токсическая дистрофия приводит к некрозу гепатоцитов, прогрессирующему разрастанию соединительной ткани и циррозу печени. Синдром холестаза обусловлен нарушением желчевыделительной функции гепатоцитов и поражением желчных канальцев (внутрипеченочный холестаз), а также нарушением оттока жёлчи в результате механических препятствий во внепечёночных жёлчных путях (внепеченочный холестаз). Внутрипеченочный холестаз обусловлен вирусным, алкогольным, лекарственным (контрацептивы, синтетические половые гормоны) поражением печени, а также он развивается при циррозе и склерозирующем холангите. Внепеченочный холестаз связан с образованием в желчных протоках камней, опухолями головки поджелудочной железы и другими причинами. При холестазе избыточная концентрация компонентов желчи в печени и тканях организма вызывает печеночные и системные патологические процессы, обусловливающие соответствующие клинические и лабораторные проявления болезни. Цитолитический синдром, или синдром нарушения целостности гепатоцитов, обусловлен нарушением проницаемости клеточных мембран и распадом внутриклеточных структур, некрозом гепатоцитов и выходом в плазму ферментов. В патогенезе разрушения гепатоцитов большое значение имеют активация лизосомальных гидролаз, расстройства окислительных процессов, избыток свободных радикалов и перекисей, образование аутоантител и сенсибилизированных Т-лимфоцитов, острый недостаток энергетических веществ и нарушение синтеза белков. Синдром характеризуется повышением в крови активности индикаторных ферментов (трансфераз, дегидрогеназ) и снижением концентрации секреторных ферментов (холинэстеразы, антикоагулянтов и др.), а также увеличением содержания билирубина. Синдром малой печёночно-клеточной недостаточности характерен для начальной фазы расстройств функций печени,в основном синтеза белков, предшествующей развитию тяжелой печеночной недостаточности и коме. Этот синдром возникает после действия гепатотропных ядов или может быть следствием любого из рассмотренных выше синдромов (воспалительного, дистрофического, холестатического, цитолитического). Для данного синдрома характерно снижение в сыворотке крови содержания общего белка, альбуминов, факторов свёртывания крови, холестерина, фосфолипидов, жёлчных кислот, уменьшение активности секреторных ферментов и повышение концентрации билирубина. Портальная гипертензия Синдром портальной гипертензии – тяжелое осложнение заболеваний печени, характеризующееся застоем крови и повышением давления в системе воротной вены. Портальная гипертензия может возникать в результате врожденных аномалий развития воротной вены (сужение просвета), ее тромбоза при септических процессах в органах брюшной полости, а также в результате сдавления сосуда опухолями или воспалительным инфильтратом. Наиболее часто синдром портальной гипертензии наблюдается у больных циррозом печени. При осложнении цирроза печени тромбозом воротной вены развивается смешанная, или комбинированная форма синдрома портальной гипертензии. При портальной гипертензии вследствие резкого повышения гидростатического давления в системе воротной вены (в 1,5 -2 раза) часть крови оттекает из бассейна портальной вены в полую вену через естественные портокавальные анастомозы. Они начинают функционировать в области кардиального отдела желудка и абдоминального отдела пищевода, вен прямой кишки, а также между пупочной и полой венами. При выраженном расширении портокавальных анастомозов могут наблюдаться пищеводные и ректальные кровотечения, а на передней брюшной стенке пациентов возникает своеобразный рисунок извитых расширенных подкожных вен передней брюшной стенки, обозначаемый термином "голова медузы". Синдром портальной гипертензии часто сопровождается увеличением размера селезенки и приводит к развитию асцита – брюшной водянке, представляющей собой скопление транссудата в брюшной полости. В его генезе, кроме повышения давления крови в портальной системе, важное место занимает уменьшение концентрации белков крови (гипопротеинемия) и задержка натрия, вследствие недостаточного метаболизма альдостерона в печени (вторичный гиперальдостеронизм). Портальная гипертензия сопровождается существенным уменьшением крово- и лимфообращения в печени, многообразными метаболическими и структурными нарушениями в других органах и тканях. Желтуха Желтуха (греч. ikteros) – это синдром, характеризующийся желтушным окрашиванием кожи и слизистых оболочек, обусловленный накоплением в тканях и крови билирубина. Он возникает в результате нарушений пигментного обмена в печени (процессов образования, захвата, связывания билирубина и выведения билирубина из организма). Выделяют три основных вида желтух: г емолитическую (надпечёночную), паренхиматозную (печёночную) и механическую (обтурационную или подпечёночную). Надпечёночная желтуха не связана с печеночной недостаточностью. Она возникает вследствие усиленного врожденного или приобретенного (переливание несовместимой крови, действие гемолитических ядов, сепсис, лекарства) разрушения эритроцитов. В результате интенсивного гемолиза эритроцитов в крови появляется избыточное количество свободного (непрямого, неконъюгированного) билирубина, который гепатоциты, даже при максимальной функциональной нагрузке, не способны вывести из крови с желчью в кишечник. В кишечник по желчным протокам поступает увеличенное количество прямого билирубина, где он подвергается биохимическим превращениям. Метаболиты билирубина, образовавшиеся в большом количестве в кишечнике, обнаруживаются в высоких концентрациях в крови и моче (уробилиноген), а также в кале (стеркобилиноген, желчные кислоты). Кал и моча приобретают характерный для этого вида желтухи темный цвет. Печёночная желтуха возникает в результате изолированного или сочетанного нарушения процесса захвата (из крови), связывания (с глюкуроновой кислотой) и выведения из гепатоцитов билирубина. Выделяют три вида печеночных желтух: паренхиматозную (печёночно-клеточной), энзимопатическую, а также холестатическую (подпеченочную). Паренхиматозная желтуха встречается наиболее часто и протекает она особенно тяжело. Паренхиматозная желтуха связана с поражением гепатоцитов. Она вызывается различными гепатотропными патогенными факторами (вирусами, бактериями, паразитами, четырёххлористым углеродом, алкоголем, аутоантителами). Характер и выраженность структурных, метаболических и функциональных нарушений печени зависят от тяжести патологии и количества повреждённых гепатоцитов. В динамике паренхиматозной желтухи выделяют три стадии. Первая (преджелтушная) стадия характеризуется снижением активности печеночных ферментов, разрушающих уробилиноген, поэтому это метаболит билирубина появляется в крови и в моче (уробилиногенемия и уробилиногенурия). Повреждение и нарушение проницаемости мембран гепатоцитов приводит к повышению в крови активности “печеночных” ферментов (аланинаминотрансферазы, аспартатаминотрансферазы и других) и уменьшение активности глюкуронилтрансферазы, ответственной за процесс образования прямого (конъюгированного) билирубина. На второй (желтушной) стадии паренхиматозной желтухи наряду с уробилиногенемией, а также высокой активностью “печеночных” ферментов развивается холемия – в крови появляются желчные кислоты и прямой (связанный) билирубин. Выход желчи из желчных протоков в кровь обусловлен высокой проницаемостью клеточных мембран и нарушением оттока желчи вследствие сдавления внутрипеченочных желчных ходов отечными клетками. Во второй стадии, наряду с иктеричностью кожных покровов и слизистых оболочек, вследствие появления в крови прямого билирубина, моча приобретает темный цвет. В третьей (нарастающая желтушная) стадии из-за выраженного ослабления процесса биотрансформации непрямого билирубина в прямой, а также усиленного гемолиза эритроцитов резко возрастает концентрация свободного (токсичного) гемоглобина. Нарушение конъюгации свободного гемоглобина в печени приводит к уменьшению концентрации прямого билирубина в желчи и кишечнике. Уробилиноген из крови исчезает, а кал обесцвечивается. На этой стадии паренхиматозной желтухи состояние больные, как правило, тяжелое, они находятся в прекоматозном состоянии или коме. Энзимопатическая печеночная желтуха вызывается наследственно обусловленными нарушениями метаболизма билирубина в гепатоцитах. Желтуха связана с недостаточностью синтеза в гепатоцитах ферментов, обеспечивающих захват непрямого билирубина из крови, а также биотрансформацию непрямого билирубина или экскрецию прямого билирубина в жёлчные капилляры. Наиболее частой формой энзимопатической желтухи является синдром Жильбера. При синдроме Жильбера снижен захват и конъюгация свободной формы билирубина в гепатоцитах, что приводит к умеренному увеличению концентрации непрямого билирубина в крови. Эта форма энзимопатической желтухи встречается у 5% населения и передается по аутосомно-доминантному типу. Подпечёночная (холестатическая, обтурационная, механическая) желтуха возникает в результате внутри- и/или внепеченочного затруднения оттока желчи в двенадцатиперстную кишку. В результате нарушения оттока и застоя жёлчи во внутрипечёночных желчных путях возникает холестатическая желтуха. Холестаз в печени наблюдается при циррозе, вирусном гепатите, а также он может быть вызван лекарственными препаратами (пероральные контрацептивы, производные тестостерона и др.). Обтурационная форма желтуха развивается при затруднении оттока жёлчи по внепечёночным желчным путям (закупорка просвета желчных протоков камнями, паразитами, сдавление стенок рубцами, опухолями и инфильтратами). Нарушение оттока желчи приводит к переполнению желчных протоков, в них повышается гидростатическое давление, происходит перерастяжение и разрывы стенок желчных путей. При повреждении стенок желчевыводящих путей компоненты жёлчи проникают в кровоток (холемия), а при разрыве внутрипеченочных жёлчных протоков – желчь попадает в печёночную ткань. В местах разрыва внутрипеченочных желчных протоков развивается вторичный билиарный цирроз. Для подпеченочной желтухи характерны холемия и уменьшение поступления желчи в кишечник - синдром гипо – или ахолии. Холемия (от греч. chole – жёлчь, haima – кровь, то есть «желчекровие») означает повышение на фоне холестаза содержания в крови составных частей жёлчи (жёлчных кислот, прямого билирубина). Клиническим проявлением холемии является желтуха, кожный зуд, урежение частоты сердечных сокращений (брадикардия), артериальная гипотензия. Гипо - или ахолия (от греч. hypo-, а- – приставки, означающие снижение и отсутствие признака, chole – жёлчь) означает снижение или отсутствие жёлчи (жёлчных кислот и пигментов) в кишечнике и кале. Недостаточное поступление желчи в кишечник приводит к нарушению процессов полостного пищеварения, развитию дисбактериоза и кишечной аутоинтоксикации. Происходит нарушение гидролиза и всасывания жиров, жирорастворимых витаминов (А,D,Е,К), угнетается моторика кишечника, а также развивается стеаторея (высокое содержание жира в кале). Гепатит Гепатит (от греч. hepar, hepatos – печень, -itis – суффикс, означающий воспаление) – воспаление паренхимы печени. Среди гепатитов различают первичные (самостоятельные болезни) и вторичные – осложнения других заболеваний (пневмонии, малярии, бруцеллеза). По происхождению первичные гепатиты бывают инфекционными (вирусные, микробные) и неинфекционные (алкогольные, лекарственные, аутоиммунные). Гепатиты протекают остро (до 6 мес) и хронически (свыше 6 мес). Острые гепатиты В мире около 3 млрд человек инфицированы разными видами вирусов гепатита. Из них ежегодно более 2 млн больных умирают, преимущественно от острого вирусного гепатита. Согласно международной классификации острые вирусные гепатиты (ОВГ) рассматриваются как острое воспаление и некроз ткани печени, вызванные гепатотропными вирусами (А, В, С, D, Е, F,G). Одни вирусы гепатита (в частности, А, Е и F) передаются энтеральным (фекально-оральным) путём через воду, пищу, грязные руки, хотя не исключена возможность воздушно-капельной передачи. Другие (В, С, D, G) проникают в организм парентерально - через кровь и ее продукты, а также через секреты организма. Вирусы первой группы обычно вызывают гепатит с полностью обратимым течением и он, как правило, не переходит в хроническую форму. Поражение печени вирусами второй группы часто завершается формированием хронической формы гепатита, а также развитием цирроза и первичного рака печени. Гепатит А вызывается РНК-содержащим вирусом (HAV). Факторами риска развития гепатита А являются перенаселённость людей, несоблюдение правил личной гигиены, контакты с больными гепатитом. Около 80% заболевших являются детьми моложе 15 лет. Инкубационный период заболевания составляет от 15 до 50 дней. Вирус гепатита А не вызывает острой массивной деструкции гепатоцитов. Повреждение гепатоцитов, возникающие в ходе течения вирусного гепатита A, обусловлены не репликацией и прямым цитопатическим действием вируса, а запускаемыми им иммунными механизмами. В 90% случаев наблюдается полное выздоровление. У остальных пациентов сохраняются остаточные явления заболевания (склероз печени, холецистит и др.). Гепатит Е вызывают РНК-содержащие вирусы (HEV). Механизм передачи инфекции – фекально-оральный, заражение происходит в основном при употреблении воды. Наиболее часто заболевание регистрируется в возрастной группе 15-29 лет. У наркоманов не исключена возможность парентерального заражения. Основным звеном патогенеза является цитопатическое действие вируса. Репликация вируса происходит в гепатоцитах. Инкубационный период составляет от 17 до 75 дней. Особенно высокая летальность (до 20%) отмечается у женщин, заболевших во II-III триместре беременности. Гепатит F вызывается вирусом, относящимся к ДНК-содержащим возбудителям (HFV), он передается энтеральным путем. Клинически этот гепатит напоминает грипп, острый гастроэнтерит. Характеризуется болезненной печенью, увеличением активности трансаминаз в сыворотке, наличием билирубина в моче и желтушностью. Гепатит В вызывают ДНК-содержащие вирусы (HBV). Гепатитом В во всем мире страдает более 2 млн человек, число носителей превышает 350 млн. Восприимчивость людей к вирусу очень высокая. Наибольшая заболеваемость регистрируется в возрастной группе 20-29 лет. В группу риска входят наркоманы, проститутки, гомо- и бисексуалы, работники здравоохранения, работающие с кровью, больные на гемодиализе и лица, нуждающиеся в инъекциях и переливаниях крови. Вирус передается от больной матери плоду во время родов. Инкубационный период заболевания составляет от 15 до 180 дней. Вирус накапливается в клетках печени, клетках системы мононуклеарных фагоцитов костного мозга, крови, лимфатических узлов и селезенки. Он не обладает цитотоксичностью, но имеют высокую иммуногенность. Поэтому клетки иммунной системы организма (Т-лимфоциты), реагируя на чужеродный белок вируса, разрушают его и сам гепатоцит. Если вирусный белок обладает большой схожестью с белками организма, то реакция иммунной системы менее выраженная, а болезнь в 10–15% случаев принимает хроническое течение. Гепатит В инициирует развитие цирроза и первичный рак печени. Вирус гепатита D (HDV) состоит из генома (РНК вируса) и белка, кодирующего, синтез специфического дельта-антигена. Механизмы передачи вируса такие же, как и у вируса гепатита В. Этот вирус проявляет своё высоко патогенное действие лишь в присутствии в организме вируса гепатита В, поэтому его именуют “дефектным вирусом-спутником”. При инфицировании больных гепатитов В вирусом D осложняется течение и ухудшается прогноз болезни. В 90% случаев заболеваний развивается хроническая форма гепатита, переходящая в цирроз и рак печени. Источниками заболевания гепатитом С являются больные острыми и хроническими формами вирусной инфекции (HCV). Механизм и пути передачи во многом сходны с вирусом гепатита B. В мире этим вирусом инфицировано более 200 млн человек. Гепатитом С страдают от 2 до 21% всех заболевших острым вирусным гепатитом. Вирус обладает низкой иммуногенностью, но он оказывает выраженное цитопатическое действие. Заболевание отличается длительным бессимптомным течением и очень высокой (до 60–80%) вероятностью перехода в хроническую форму с последующим развитием цирроза и рака печени (до 30%). Гепатит G вызывается РНК-содержащим вирусам (HGV). К группе риска составляют те же лица, что и для вируса гепатита B. Репликация вируса происходит в печени и в лейкоцитах. Вирус выделяется со слюной. У 10–20% больных развивается хронический гепатит. Желтуха возникает практически в 100% случаев. Хронические гепатиты Хронический гепатит – диффузное воспаление печени, сопровождающееся прогрессирующими деструктивно-дистрофическими нарушениями и развивающееся, как правило, в результате нелеченных или плохо леченных острых вирусных гепатитов В, D и С. В мире свыше 350 млн человек являются хроническими носителями разных видов вирусов гепатита. Количество больных хроническими формами и лиц-носителей вируса гепатита С только в России составляет около 2 млн человек. Причём больных с безжелтушными формами гепатита С в 3-6 раз больше, чем с синдромом желтухи. Хронические гепатиты вызывают, как правило,различные гепатотропные вирусы, они имеют клинические проявления или протекают бессимптомно более, чем полугода. Хронический гепатит трансформируется из острого заболевания, которое протекает с частыми обострениями и рецидивами. В патогенезе хронического гепатита B ведущую роль играют включение вируса в геном гепатоцита, его активная репликация в период обострения и ответные иммунопатологические реакции организма. Кроме вирусного, существуют и другие виды хронического гепатита (алкогольный, аутоиммунный, лекарственный и другие). Алкогольное поражение печени. Граница между безопасным (полезным) и рискованным потреблением алкоголя составляет ориентировочно 30 г/сут чистого алкоголя для мужчин и 16 г/сут для женщин. У женщин вероятность поражения печени выше, чем у мужчин, вследствие низкой активности фермента - алкогольдегидрогеназы (ADH) в слизистой желудка. При злоупотреблении алкоголем возможно развитие алкогольного стеатоза, алкогольного гепатита и цирроза. Этанол подавляет в гепатоцитах окисление жирных кислот, усиливает синтез и уменьшает катаболизм холестерина. Это приводит к ожирению гепатоцитов и стеатозу. После 3-5 летнего систематического употребления алкоголя развивается алкогольный гепатит. Основным механизмом поражения печени является прямое гепатотоксическое действие ацетальдегида – основного метаболита этанола. Связывание ацетальдегида с основными белками гепатоцитов приводит к необратимому клеточному повреждению, а его взаимодействие с внеклеточными белками стимулирует внутриклеточный склероз. Важная роль в патогенезе алкогольного гепатита отводится кислородным радикалам, образование которых в сочетании с истощением глутатиона приводят к разрушению липидных мембран гепатоцитов. У 8-20% интенсивно пьющих людей развивается алкогольный цирроз. Он характеризуется прогрессирующим фиброзом печени и образованием ложных соединительнотканных долек. Клинические проявления алкогольных заболеваний печени неспецифичны, включают в себя портальную гипертензию, желтуху и асцит, а также эндокринные нарушения, связанные с ингибированием этанолом синтеза половых гормонов. Прогноз заболевания определяется развитием цирроза (10-15% случаев). Отказ от употребления алкоголя увеличивает 5-летнюю выживаемость лиц с циррозом, желтухой и асцитом на 20 %. Аутоиммунный гепатит имеет хроническое течение. Причина его возникновения не установлена. Заболевание развивается преимущественно (70%) у молодых женщин. Заболевания может начинаться как острый гепатит. Однако, наряду с поражением гепатоцитов, в крови больных выявляются аутоантитела к клеточным белкам печени. Хронический гепатит, вызываемый лекарствами, по своим признакам напоминает аутоиммунный гепатит: при отсутствии маркеров вирусной инфекции в плазме обнаруживаются аутоантитела белкам печени.. Отмена лекарств, предположительно вызвавших хронический гепатит, как правило, сопровождается значительным улучшением состояния больного. Хронический лекарственный гепатит часто выявляется случайно, без диагностированного ранее эпизода острого гепатита. В печени наблюдается поражение долек и выраженный фиброз. Данный тип поражения печени вызывают изониазид, фибраты, миноциклин и нитрофураны. Гепатоз Гепатоз (от греч. hepar, hepatos – печень, -osis – суффикс, означающий патологическое состояние, болезнь) – хроническое заболевание, которое сопровождается дистрофическими изменениями клеток паренхимы печени. Наиболее часто встречается жировая дистрофия гепатоцитов, приводящая к жировому гепатозу (стеатоз печени). Он возникает, главным образом, в результате злоупотребления алкоголем и действия гепатотоксических веществ (в том числе лекарств). Жировой гепатоз развивается при сахарном диабете, общем ожирении, синдроме Иценко-Кушинга, длительном лечении глюкокортикоидами, несбалансированном питании (избыток жиров и углеводов, недостаток белков, дефицит липотропных веществ в пище: метионина, липокаина, холина, витамина В12). Цирроз печени Цирроз (от греч. k
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 126; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.1.100 (0.015 с.) |