Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Роль кальция в гемостатических реакцияхСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Роль кальция в гемостазе огромна. Большинство белков гемостаза имеют сайты связывания кальция. При удалении кальция из плазмы (например, при смешивании крови с цитратом натрия) активировать гемостатические реакции практически невозможно. Наиболее важные из известных функций кальция в гемостазе: • Участие в образовании связей витамин-К-за- • Участие в активации фактора XIII. • Участие в образовании связи ф.VII и ткане • Ускорение процесса роста фибринового сгу на и фибрина от температурной и щелочной денатурации. • Стабилизация структуры многих белков ге • Участие в процессах активации тромбоцитов • Кальций необходим для формирования цитос- • Кальций участвует в регуляции большинства Плазменные белки гемостаза Ингибиторы системы свертывания плазмы крови Ингибиторы системы свертывания крови представлены в табл. 7. Ингибиторы системы свертывания плазмы крови Таблица 7
Ингибиторы ферментов системы гемостаза
Среди ингибиторов ферментов системы гемостаза, в свою очередь, можно условно выделить 2 группы - ингибиторы сериновых протеаз и неспецифические ингибиторы протеаз, к которым относится α2-макроглобулин. Ингибиторы сериновых протеаз, или серпи-ны. Большинство ферментов каскада свертывания крови составляют сериновые протеазы. Се-риновыми протеазами также являются ферменты фибринолитической системы, некоторые ферменты системы комплемента, эластаза, трипсин, химотрипсин и многие другие. Все они имеют гомологичную структуру. Существует группа ингибиторов, специфичных для сериновых протеаз, - серпины. Механизм их ингиби-рующего действия изучен довольно хорошо. Серпины имеют строение, похожее на строение субстрата сериновых протеаз. Однако, охотно соединяясь с ферментами, серпины не подвергаются немедленному расщеплению. Это соеди-
нение блокирует ферментативную активность сериновой протеазы (рис. 48). Различные серпины несколько отличаются по строению, могут быть более или менее специфично ингиби-ровать разные ферменты. Кроме того, на актив-
Рис. 48. Ингибирование активных сериновых протеаз серпинами за счет образования стабильного неактивного фермент-субстратного комплекса Плазменные белки гемостаза ность и специфичность серпинов может влиять микроокружение. Антитромбин и гепарин Антитромбин (синоним - антитромбин III, AT) - гликопротеин, состоит из 432 аминокислот и имеет 4 участка гликолизации с разным количеством сиаловых кислот. Этот ингибитор формирует стабильный 1:1 комплекс с сериновыми протеа-зами плазменного гемостаза. Кроме того, AT связывается со специфическими сульфатными группами на пентасахаридных структурах гепарина. AT синтезируется в печени и является наиболее значимым ингибитором системы свертывания крови. Активности находящегося в крови здорового человека антитромбина достаточно, чтобы ингиби-ровать в три раза больше тромбина, чем может образоваться из циркулирующего протромбина. Несмотря на это, уже при снижении активности AT в плазме ниже 60% возрастает риск патологических тромбозов. При изолированном дефиците активности AT риск тромботических проявлений возрастает пропорционально степени снижения активности. Помимо тромбина, AT ингибирует фактор Ха, а также факторы IХа, ХIа, ХIIа и калликреин. Антитромбин по структуре гомологичен α1 -антитрипсину. В его активном центре присутствует специфическая связь Arg-Ser, которая и взаимодействует с сериновыми протеазами.
Активность AT в десятки тысяч раз усиливается в присутствии отрицательно заряженных гли-козаминогликанов, таких, как гепарансульфат, входящих в структуру гликокаликса на поверхности эндотелиальных клеток. Аналогичное потенциру-
ющее действие на AT оказывает гепарин (рис. 49), вырабатываемый тучными клетками. Антикоагу-лянтное действие гепарина связано с его способностью вызывать конформационные изменения AT. Функция гепарина каталитическая. После образования эквимолярного 1:1 комплекса тромбин-антитромбин (ТАТ) гепарин может освобождаться для организации других комплексов. Нефракционированный гепарин представляет собой смесь гепаринов различной молекулярной массы. До последнего времени он широко применялся в клинической практике как антикоагулянт. В настоящее время большее распространение получили препараты низкомолекулярного гепарина (НМГ, английская аббревиатура - LMWH), который получается из гепарина химической или энзиматической обработкой. Гепарин не только значительно усиливает активность AT, но и модулирует его ингиби-торную активность. Для стабилизации комплекса ТАТ гепарин должен быть представлен структурой, имеющей, по крайней мере, 18 моносахаридных оснований. Нефракционированный гепарин связывается одновременно как с ферментом, так и с AT, тогда как НМГ связывается только с молекулой AT (рис. 50). Нефракционированный гепарин усиливает активность AT в отношении всех сериновых про-теаз каскада свертывания крови, тогда как низкомолекулярный - в основном в отношении ф.Ха. Наиболее эффективно AT «работает» в токе крови. В составе протромбиназного комплекса (рис. 41), содержащем также фосфолипиды, Са и ф.Vа, фактор Ха лучше защищен от ингибирова-ния комплексом АТ-гепарин.
Рис. 50. Эффект нефракционированного гепарина (молекулярная масса до 30 кДа) по стабилизации комплекса тромбин-антитромбин и низкомолекулярного гепарина (молекулярная масса 3 кДа), предпочтительно влияющего в качестве кофактора на образование комплекса фактор Ха - антитромбин, ТАТ - тромбин-антитромбино-вый комплекс
Плазменные белки гемостаза
Гепарин и НМГ широко используются для профилактики и лечения тромбозов. Антикоагулянтное действие гепарина можно быстро и обратимо снять внутривенным введением протаминсульфата - основного белка, содержащегося в сперме рыб и ковалентно связывающегося с гепарином. Гепарин, помимо активации AT, обладает дополнительными антикоагулянтны-ми эффектами. Очень важной функцией является нейтрализация гепарином тромбоцитарного фактора 4, который освобождается из а-гранул, а также стимуляция гепарином освобождения из сосудистой стенки ингибитора внешнего пути (TFPI) и кофактора гепарина П. Серьезным осложнением гепаринотерапии может быть развитие гепариновой тромбоцито-пении и рикошетных тромбозов (см. раздел «Тромбоцитопения, вызванная гепарином»). Комплекс тромбин-антитромбин Продукт взаимодействия тромбина и AT (ТАТ) - неактивный комплекс, в нем тромбин и AT быстро теряют свою активность. ТАТ удаляется из системы циркуляции печенью в течение нескольких минут. Увеличение ТАТ в системе циркуляции свидетельствует о развитии гиперкоагуляции с увеличением образования тромбина. В частности, ТАТ повышен у пациентов с гипергомоцис-теинемией, которая вызывает, по-видимому, воспалительную реакцию на уровне эндотелиальных клеток. У таких больных увеличен риск тромбо-эмболической болезни и окклюзии артериальных сосудов. После лечения фолиевой кислотой и витамином В6 ТАТ значительно снижается.
Кофактор гепарина II Другим серпином, инактивирующим тромбин, является кофактор гепарина П. Однако, в отличие от антитромбина, кофактор гепарина II более избирателен и не ингибирует активность других сериновых протеаз системы свертывания крови. Помимо тромбина, субстратом инактивации для кофактора гепарина II являются химо-трипсин и катепсин Н. С1-ингибитор С1-ингибитор (Cl-Ing) - наиболее важный ингибитор факторов контактной активации (см. раз- дел «Внутренний путь образования протромби-назы. Факторы контактной активации»). С1-ин-гибитор-высокогликозилированный серпин, ин-гибирующий факторы ХПа, ХIа, калликреин, плазмин и субкомпоненты Clr и Cls первого компонента системы комплемента. Вклад С1-ингибитора в систему гемостаза, вероятно, не очень велик, так как его дефицит не проявляется ни кровоточивостью, ни тромбозами. Основное проявление дефицита С1-ингибитора -рецидивирующие ангионевротические отеки. α2 -макроглобулин
α2-макроглобулин - гликопротеид, неспецифический ингибитор протеаз. Это крупный белок с молекулярной массой 725 000 Да. Механизм его действия отличается от такового у серпинов. Он действует по принципу мышеловки, у которой дверца захлопывается после попадания объекта внутрь (рис. 51). Образуя связи с внутренними пептидами α2-макроглобулина, протеазы не могут расщепить такой высокомолекулярный субстрат. α2-макроглобулин имеет большую емкость по связыванию протеиназ, но относительно низкое сродство. Он включается в физиологическую инактивацию протеиназ после истощения других ингибиторов, обладающих высоким сродством, но относительно низкой емкостью. Он инактивирует большинство протеаз, включая ферменты системы свертывания крови и фибринолиза. Потребление α2-макроглобулина обычно обнаруживают в состояниях повышенной протеолитической активности, в частности при панкреатитах. У новорожденных содержание α2-макроглобулина примерно в 2 раза выше, чем у взрослых.
Плазменные белки гемостаза Ингибиторы коферментов
Система протеина С Система протеина С включает непосредственно сам протеин С (ПС) и его кофактор протеин S (ITS). Другими компонентами системы являются мембранный белок тромбомодулин (ТМ), рецептор протеина С на эндотелиальных клетках (РПСЭК) и С4-связывающий протеин. Система протеина С вместе с антитромбином и ингибитором внешнего пути - наиболее важные и эффективные компоненты, очищающие плазму от активированных кофакторов плазменного гемостаза и ограничивающие процесс свертывания крови.
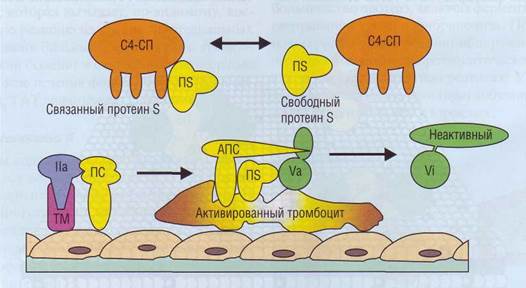
Протеин С Протеин С (ПС) - витамин-К-зависимый белок плазмы, синтезируется в печени. Активированный протеин С (АПС) является специфической сериновой протеазой, сходной по структуре с другими витамин-К-зависимыми сериновыми протеазами. Основная функция его в гемостазе -инактивация факторов Va и VIIIa. Помимо это- го, он ингибирует PAI, что приводит к усилению фибринолиза. Активация ПС происходит на поверхности эндотелиальных клеток. ПС связывается с РПСЭК на эндотелиальной мембране и контактирует с комплексом тромбин-тромбомодулин. Происходит ограниченный протеолиз неактивного ПС с образованием активной сериновой про-теазы. АПС способен инактивировать факторы Va и Villa, расположенные на мембране активированных тромбоцитов или других клеток, в присутствии ионов Са2+. Протеин S является кофактором этой реакции (рис. 52). Механизм инактивации факторов Va и VIII протеином С заключается в их лизисе. Время полувыведения АПС из плазмы примерно 15 мин. Фактор Виллебранда (vWF) защищает ф.VШ от протеолитического воздействия протеина С. При типе 2N болезни Виллебранда мутация затрагивает сайт vWF, связывающий ф.VIII. Последний лишается защиты и подвергается ускоренному разрушению АПС, что приводит к снижению его активности в крови. ф.VIII в комплексе с ф.IХ и ф.V в комплексе с ф.Х также относительно защищены от инактивации. Основным ин-
Рис. 52. Деградация активных факторов Va и Villa активированным протеином С (АПС), Транспортный С4-связыва-ющий протеин (С4-СП) доставляет протеин S (F1S), участвующий как кофактор в формировании комплексов на фосфоли-пидной мембране Плазменные белки гемостаза
гибитором АПС является PAI-3, который иногда обозначают как протеин С ингибитор (ПСИ, в английской аббревиатуре PCI), другим ингибитором АПС является α2-макроглобулин. Значение протеина С в системе гемостаза чрезвычайно велико. Пациенты с дефицитом протеина С страдают венозными и артериальными тромбозами. Выраженность тромбофилии коррелирует с тяжестью дефицита этого белка. Пациенты с гомозиготным дефицитом протеина С не описаны, видимо, это состояние не совместимо с жизнью. Протеин S Протеин S (ПS) - витамин-К-зависимый белок, синтезируемый в печени. Протеин S присутствует в плазме частично в свободном состоянии, частично в комплексе с С4-связывающим протеином (С4-СП), который доставляет протеин S на фосфолипидную мембрану. Это важно учитывать, так как комплекс протеин S - С4-СП не обладает кофакторной активностью по отношению к протеину С. Только свободный протеин S является кофактором АПС. Активность АПС в кооперации со свободным протеином S значительно выше, чем без него.
Дефицит nS, так же как и дефицит ПС, приводит к развитию тромбозов. Тяжесть течения тромбофилии при дефиците nS также пропорциональна степени снижения его активности, а гомозиготные формы дефицита nS неизвестны. На рис. 53 схематично представлена последовательность взаимодействий компонентов системы протеин С - протеин S при инактивации фактора Va. С4-связывающий протеин С4-связывающий протеин (С4-СП) - острофазный белок, синтезируется в печени. В плазме присутствует в виде молекулы, содержащей 7 идентичных ос-цепей и одну β-цепь (рис. 54). Сниженный уровень С4-СП имеет место у новорожденных и лиц, принимающих непрямые антикоагулянты. Повышение С4-СП наблюдается при воспалении, активации аутоиммунных реакций, при беременности, у женщин, принимающих стероидные контрацептивы; при этом происходит избыточное связывание протеина S. Дефицит свободной формы протеина S рассматривается как фактор риска тромбофилии. С4-СП способен также регулировать активность системы комплемента, образовывать Са-зависимые комплексы с амилоидным
Рис. 53. Система протеина С. Активированный протеин С (АПС), сопрягаясь с теназным комплексом на фосфолипид-ной поверхности (активированный тромбоцит), вызывает деградацию фактора V. ТМ - тромбомодулин, С4-СП - связывающий протеин, F1S - протеин S, ПС - протеин С, На, Va - активированные плазменные факторы, Vi - деградированный фактор V Плазменные белки гемостаза
Рис. 54. Схематическое изображение α- и β-цепей С4-cвязывающего протеина и участок связывания протеина S Р-белком сыворотки. Определение С4-СП возможно методом иммунотурбидиметрии или ELISA. Концентрация С4-СП в сыворотке составляет в норме около 200 мкг/мл. Тромбомодулин был описан ранее в разделе, посвященном функции эндотелия. Нарушения в системе протеина С (рис. 55), среди которых выделяют дефицит протеина С, дефицит тромбомодулина, дефицит протеина S и особенно резистентность к активированному протеину С (РАПС), - наиболее изученная па-тоология, значительно увеличивающая риск па-тоологического тромбообразования - тромбо-филии.
Рис. 55. Нарушения в системе протеина С, способствующие развитию тромбофилий: 1 -дефицит протеина С, 2 -дефицит тромбомодулина, 3 - дефицит протеина S, 4 - резистентность к активированному протеину С Система протеина С активно реагирует на развитие воспаления в организме. Известно, что развитие воспаления, особенно в условиях грамнега-тивного сепсиса значительно воздействует на гемо-статический баланс, вызывая гиперкоагуляцию. Это связано с несколькими эффектами в системе протеина С. Во-первых, медиаторы воспаления подавляют синтез тромбомодулина, что ведет к уменьшению активации протеина С. Во-вторых, в крови повышается активность комплемента, следствием этого является относительное увеличение количества связанного и уменьшение активного несвязанного протеина S. В-третьих, фагоцитарные ферменты могут отщеплять тромбомодулин от эндо-телиальной поверхности. Он появляется в свободной циркуляции, но его активность в этих условиях значительно ниже, чем у фиксированного на мембране. В-четвертых, стимуляция синтеза и экспрессии тканевого фактора на мембране клеток в зоне воспаления ведет к усилению синтеза факторов IХа и Ха и нарастанию дисбаланса.
|
||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 931; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.156.153 (0.012 с.) |






 Наиболее значимым ингибитором в этой группе является система протеина С.
Наиболее значимым ингибитором в этой группе является система протеина С.