
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Участие моноцитов в свертывании кровиСодержание книги
Поиск на нашем сайте Уникальными свойствами обладают моноци-ты. Это единственные клетки, способные создавать на своей поверхности условия для сборки и успешного функционирования всех ферментатив-ных комплексов системы свертывания крови. Стимулированные моноциты экспрессируют около 16 000 сайтов связывания протромбиназного комплекса. Эффективность синтеза тромбина на их поверхности сопоставима с эффективностью синтеза тромбина на поверхности активированных тромбоцитов. Синтез и экспрессия тканевого фактора, эффективно связывающего ф.VIIа, происходит на моноцитах под воздействием различных физиологических и патологических стимулов, в том числе бактериальных липополисахаридов, фактора некроза опухоли, интерлейкина-1, С-реактив-ного белка, иммунных комплексов. Сборка теназ-ного комплекса на моноцитарной мембране -ключевой момент в развитии процесса коагуляции. Комплекс тканевой фактор - ф.VIIа подавляется ингибитором пути тканевого фактора (ингибитором внутреннего пути - ИВП), также синтезируемым и экспрессируемым моноцитами. Реакции свертывания крови, протекающие на моноцитарной мембране, усиливаются специфическими для моноцитов механизмами. Фиксированные на поверхности моноцитов эластаза и ка-тепсин G активируют ф.V до ф.Vа, поэтому ф.V не поступает в кровоток, а остается тут же на мембране моноцитов и формирует протромбиназный комплекс с ф.Ха. Причем этот комплекс защищен от протеолиза активированным протеином С (АПС), поэтому активность протромбиназы на моноцитарной мембране длительно сохраняется на высоком уровне. Помимо ф.Vа, катепсин G активирует ф.Х. В отличие от катепсина G действие эластазы дозозависимо. В малых концентрациях она активирует ф.V, а в больших - расщепляет ф.Vа. Эластаза, видимо, не обладает способностью инактивировать ф.Ха. Однако воздействие ее высоких концентраций на ф.Х изменяет последний так, что его в дальнейшем невозможно активировать. Другим альтернативным путем, специфичным для моноцитов, является активация ф.Х после его соединения с мембранным рецептором Мас-1 (CDllb/CD18). Связавшись с Мас-1, ф.Ха частично активирует моноциты и вызывает экспрессию специфического моноцитарного рецептора EPR-1. Комплекс ф.Ха-EPR-l способен эффективно активировать протромбин в присутствии Са2+ без участия ф.Уа. Таким образом, на поверхности моноцита может собираться полноценный протромбиназный комплекс. Прокоагулянтная активность моноцитов зависит от их микроокружения. Коллагены I и IV типов, фибронектин - активные субстраты для адгезии моноцитов в отличие от ламинина. Последний адгезирует моноциты в 6-10 раз хуже. Однако именно на моноцитах, адгезированных к ламинину, процессы коагуляции развиваются Роль лейкоцитов в гемостазе в 3-5 раз быстрее, чем на мембранах моноцитов, адгезировавшихся на других субстратах. Помимо катализа гуморальных реакций свертывания крови, моноциты обладают про-агрегантной активностью. Катепсин G обладает свойством вызывать агрегацию тромбоцитов, изменение их формы, мобилизацию кальция, экзоцитоз α-гранул и плотных гранул, уси- ление адгезии тромбоцитов к лейкоцитам. Часть этих реакций катализируется моноцитар-ной эластазой. В отличие от моноцитов нейтрофилы и лимфоциты не экспрессируют PAR-1, однако исследования показали, что на изолированных популяциях этих клеток происходит сборка протром-биназных комплексов.
КАФЕДРА клд ЦИКЛЫ УСОВЕРШЕНСТВОВАНИЯ КАФЕДРЫ КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ РМАПО (Москва)
Все циклы длительностью 1 месяц и более дают право сдавать сертификационный экзамен. По окончании более коротких циклов выдаются свидетельства о повышении квалификации государственного образца. Заявки для участия в циклах усовершенствования принимаются: • по почте: 125424, Москва, а/я 32 (кафедра КЛД) • по факсу (095) 945-84-00 или телефону (095) 945-82-22 • по электронной почте: kafedra-kdl@list.ru Плазменные белки гемостаза ПЛАЗМЕННЫЕ БЕЛКИ ГЕМОСТАЗА Плазменные белки гемостаза образуют 2 ферментативные системы крови, имеющие своей целью поддержание гемостатического баланса (рис. 31): 1. Система свертывания плазмы. Система со 2. Система фибринолиза. Конечной целью этой • В обеих системах происходит многоэтапный ферментативный процесс актива- ции, в котором участвует ряд белков - про-теаз. • По крайней мере, in vitro имеется несколько • Многие реакции нуждаются в наличии спе Кроме каскадных систем свертывания плазмы и фибринолиза, к плазменным белкам гемостаза относятся многочисленные ингибиторы и активаторы, эффекты которых проявляются как действие антикоагулянтов или прокоагулянтов и соответственно ингибиторов или активаторов фибринолиза.
Рис. 31. Система свертывания крови и система фибринолиза - каскадные протеолитические ферментативные системы, обеспечивающие гемостатический баланс крови Плазменные белки гемостаза Система свертывания плазмы
Система свертывания плазмы - ферментативная система, осуществляющая каскад протео-литических реакций, в результате которых происходит образование фибриновой пробки в месте повреждения сосуда. Система свертывания тесно связана с другими протеолитическими системами плазмы, в том числе с системой фибри-нолиза. Белки свертывания плазмы, входящие в каскад свертывания крови, принято называть термином «фактор». В соответствии с международной номенклатурой факторы свертывания плазмы обозначаются римскими цифрами (табл. 6). Активные формы факторов обозначаются теми же римскими цифрами, но с добавлением аббревиатуры «а». Практически все факторы системы свертывания крови циркулируют в кровотоке в форме неактивных проэнзимов или в форме неактивных кофакторов. Исключение составляет фак- тор VII, примерно 1-2% которого в норме циркулируют в активной форме. При запуске свертывания крови происходит каскадная активация проэнзимов и кофакторов (рис. 32). Процесс активации представляет собой ограниченный протеолиз неактивных предшественников до активных энзимов и кофакторов. Активированные энзимы являются сериновыми протеа-зами (за исключением фактора XIII). Активированные кофакторы, не обладая самостоятельной ферментативной активностью, играют роль коферментов. Сериновыми протеазами являются активированные факторы II, VII, IX, X, XI, XII, ПК. Трансглютаминаза - фактор XIII. Кофакторы - факторы V, VIII, ВМК. Содержание компонентов гемостаза, в том числе плазменных факторов свертывания, в системе циркуляции существенно больше, чем необходимо
При разработке первой номенклатуры были использованы римские символы факторов от I до XIII. Для обозначения участия в свертывании плазмы тканевого фактора и ионов кальция им были приданы символы соответственно III и IV. Однако в настоящее время римская нумерация для них не используется, так как они не относятся к плазменным факторам свертывания (тканевой фактор - это тканевой компонент вне сосудистой системы, ионы Са не являются белком). Фактор VI в классификации не употребляется, так этим символом ошибочно был назван фактор Va. Плазменные белки гемостаза
Рис. 32. Протеолитическая активация факторов гемостаза. Путем ограниченного протеолиза из неактивного предшественника образуются активный пептид и активированный фермент для формирования фибринового сгустка. Процесс свертывания происходит в условиях насыщения субстратами (рис. 33). Вследствие этого образование гемостатического тромба может быть достигнуто при значительном диапазоне концентрации и активности конкретного фактора свертывания. Клинические проявления недостаточности компонентов свертывания возникают при их существенном уменьшении, если обратиться к рис. 33 - то это начальный диапазон, при котором скорость реакции зависит от концентрации фактора. Для эффективного взаимодействия и активации белков свертывания крови необходимо образование комплексов этих белков, их кофакторов и субстрата (рис. 34). Эти условия не могут возникнуть в жидкой фазе. Поэтому большинство процессов активации промежуточных факторов свертывания протекают на фосфолипидах клеточных мембран. В месте сборки комплексов происходит концентрация факторов свертывания. Здесь же присутствуют кофакторы, которые существенно ускоряют процесс формирования сгустка. В создании активного комплекса участвуют: • Фермент (активный плазменный фактор - • Субстрат (профермент). • Активированный кофактор. • Ионы Са (Са2+). • Кислые фосфолипиды и специфические ре Все белки системы свертывания крови можно разделить на две группы. Одни белки для полноценного формирования требуют наличия витамина К (витамин-К-зависимые белки), а другие - нет. Рис. 33. Соотношение между концентрацией факторов и скоростью процесса свертывания. В норме скорость коагуляции практически не определяется концентрацией факторов, так как они присутствуют в избытке и процесс идет в состоянии насыщения. Только после значительного истощения фактора его концентрация будет влиять на скорость реакции и соответственно на скорость свертывания плазмы
Рис. 34. Модель сборки комплекса факторов свертывания крови. На поверхность твердой фазы (фосфолипиды фибробластов, макрофагов, активированных тромбоцитов либо, в патологических ситуациях, мембраны поврежденных клеток, бактерий и др,) прикрепляется (интернали-зуется) крупный кофакторный белок, который организует место контакта факторов свертывания, те в свою очередь взаимодействуют друг с другом по принципу комплементарности
Плазменные белки гемостаза Витамин-К-зависимые белки
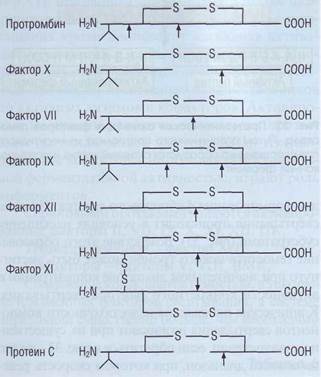
Витамин-К-зависимыми белками являются ф.II, -VII, -IX, -X, протеины С и S. Эти белки синтезируются в печени и имеют сходную структуру молекулы (рис. 35). Характерной их особенностью является наличие уникальной аминокислоты -у-карбоксиглутамина. Эта аминокислота образуется во время синтеза витамин-К-зависимых белков в печени путем у-карбоксилирования глута-мина ферментом у-карбоксиглутаминпептидазой, в работе которого принимают участие активированные формы витамина К (рис. 142). у-карбок-сиглутамин дает возможность витамин-К-зависи-мым белкам с помощью ионов Са2+ образовывать комплексы с кислыми фосфолипидами. Рис. 35. Структурная организация некоторых плазменных белков системы гемостаза. Стрелками показаны места протеолитического гидролиза, в результате которого происходит переход неактивных проферментов в активные ферменты - сериновые протеазы каскада коагуляции. Двузубцем обозначены витамин-К-зависимые факторы, имеющие в своей структуре карбоксилированную глюта-миновую кислоту Неферментные активаторы свертывания крови К неферментным активаторам свертывания крови (коферментам) относятся факторы V и VIII. Оба - высокомолекулярные белки, имеющие сходную структуру. Они циркулируют в плазме в неактивной форме и активируются тромбином. ф.VIII в плазме связан с фактором Виллебранда (vWF), который защищает его от преждевременной инактивации. Диссоциация фVIII из комплекса с vWF происходит под воздействием тромбина (рис. 25). ф.Va и -Villa образуют на фосфолипидных мембранах комплексы с ф.Ха и -IХа соответственно. Специфическая активность ф.Ха и -IХа в комплексах с кофакторами в десятки тысяч раз больше, чем изолированных. Основным ингибитором ф.Va и -VIIIa является комплекс протеин С - протеин S. Классический коагуляционный каскад активации тромбина Изучение процесса свертывания крови до настоящего времени происходит в основном in vitro в смоделированных условиях. Исследование взаимодействия плазменных белков гемостаза в отрыве от других компонентов привело к созданию так называемой «классической» теории коагуля-ционного каскада активации тромбина. В насто- ящее время эта теория пересмотрена с учетом вновь полученной информации о взаимодействии различных компонентов гемостаза. Однако базовые принципы изложенной ниже классической каскадной теории считаются верными до настоящего времени. Кроме того, знание классического каскада свертывания крови необходимо для пра-
Плазменные белки гемостаза вильнои интерпретации результатов коагулоло-гических тестов. Активация протромбина - многостадийный процесс, который происходит по механизму про-ферментно-ферментного преобразования. С одной стороны, это обеспечивает нарастание сигнала: активация одной молекулы предшествующего уровня в системе свертывания приводит к активации от нескольких десятков до нескольких сотен тысяч последующих молекул (рис. 36). С другой стороны, многостадийность позволяет более гибко регулировать процесс. В классическом каскаде свертывания крови выделяют 2 пути активации процесса:
• Активация тканевым фактором (ТФ). Так как • Активация ф.ХII при контакте с отрицатель
ренний путь свертывания (все факторы присутствуют в плазме в норме). Внешний и внутренний пути взаимодействуют между собой, а их разделение достаточно условно. Внешний и внутренний пути сходятся на факторе X. Последний со своим кофактором ф.Vа образует протромбиназу - ферментативный комплекс, который активирует протромбин с образованием тромбина. Образовавшийся тромбин поступает в ток крови и активирует фибриноген до фибрин-мономеров. Последние спонтанно соединяются, образуя полимеры фибрина. Условно свертывание плазмы (крови) делится на 2 основные фазы: 1) многоступенчатый этап, приводящий к акти
2) конечный этап, в котором под влиянием тром
Внешний путь образования протромбиназы Внешний путь образования протромбиназы короткий, что ведет к быстрому образованию тромбина. При контакте ТФ и ф.VIIа формируется комплекс, который активирует ф.Х. Фактор Ха при участии фактора Va, в присутствии ионов Са2+, на отрицательно заряженной фосфолипидной поверхно- сти формирует протромбиназу. В настоящее время полагают, что внешний путь - основной физиологический путь запуска процесса свертывания крови. Подробно его значение будет описано в разделе «Современная теория свертывания крови». Активность внешнего пути поддерживается за счет механизма положительной обратной свя-
Плазменные белки гемостаза
зи (рис. 38). Положительная обратная связь включается на нескольких этапах каскада свертывания. Наиболее существенными являются активация тромбином факторов VII и V. Рис. 38. Внешний каскад свертывания крови. Начинается с контакта крови с тканевым фактором (ТФ), который, взаимодействуя с ф.VIIа, образует комплекс, активирующий ф,Х, Усиление активности внешнего каскада свертывания крови обеспечивается 2 механизмами положительной обратной связи
Внутренний путь образования протромбиназы. Факторы контактной активации
Факторы контактной активации - ф.ХII, пре-калликреин, высокомолекулярный кининоген, С1-ингибитор - синтезируются в печени. In vitro эти белки участвуют в активации внутреннего каскада свертывания. В лабораторных условиях активация происходит на некоторых небиологических отрицательно заряженных поверхностях, например на стекле, каолине, кремнии, сульфате декстрана, а также в присутствии эллаговой кислоты. Имеются данные, что важным механизмом активации контактных факторов является их взаимодействие с поверхностью, характеризующейся свойствами твердой фазы. В патологических условиях контактная активация, вероятно, происходит на мембранах клеток крови и эндотелия, а также при контакте с коллагеном субэндотелия. Схематично взаимодействие белков при контактной активации показано на рис. 39. Видимо, в «подходящих условиях» происходит аутоактивация и взаимоактивация ф.ХII, ПК до активных ферментов. In vitro активация контактной системы приводит к активации ф.ХI, который в свою очередь активирует ф.IХ, образующий с ф.VIII теназный комплекс. Теназный комплекс (название комплекса происходит от английского слова ten - десять) активирует ф.Х, а далее процесс свертывания идет по уже описан- ному пути. Поскольку сборка теназного комплекса происходит на фосфолипидной поверхности, для нее необходимо присутствие ионов кальция. Контактная фаза активации поддерживается положительной обратной связью. Тромбин активирует ф.VIII и -XI. Физиологическое значение контактной активации, роль факторов контактной активации в процессе свертывания крови, физиологические активаторы и условия активации этих факторов в организме требуют дальнейшего изучения.
Рис. 39. Контактная фаза активации плазменных факторов. Контакт с поверхностью твердого тела вызывает активацию фактора XII, который запускает каскад свертывания плазмы, каскад активации фибринолиза, активацию калликреин-кининовой системы (положительная обратная связь) и активацию системы комплемента (отрицательная обратная связь) Плазменные белки гемостаза Классическая теория свертывания крови оставляла слишком много вопросов и противоречила клиническим данным. Например, с одной стороны, было неясно, какая поверхность в физиологических условиях является активатором, с другой стороны, почему дефицит факторов внутреннего пути (ф.VIII, -IX, -XI) приводит к выраженной кровоточивости при нормальной активности факторов внешнего пути, а глубокий дефицит факторов контактной активации, как правило, не сопровождается геморрагическим синдромом. В современной каскадно-матричной теории гемостаза эти противоречия разрешены. С современной точки зрения, контактная активация играет большую роль во взаимодействии системы свертывания крови с другими протеоли-тическими системами крови (фибринолитичес-кой, ангиотензин-рениновой, калликреин-кини-новой, системой комплемента и др.). В настоящее время изучены следующие функции белков контактной активации: 1. Брадикинин стимулирует повышение внутри • Вазодилатации и снижению артериально • Активации системы фибринолиза путем • Ингибированию активации тромбоцитов. • Стимуляции репарации и росту гладкомы-
2. Прямое ингибирование тромбин-индуциро- 3. Активация фибринолиза.
• Непосредственная активация плазмино • Активация калликреином проурокиназы
4. Блокада клеточной адгезии. 5. Антиангиогенное действие. 6. По-видимому, контактная активация играет Внутренний путь образования протромбиназы (рис. 40) включает активирующее действие ф.ХПа на ф.Х1, который в свою очередь активирует ф.1Х. Поскольку значение контактной активации в процессе свертывания крови переосмыслено, физиологическая роль ф.Х1 изучается. Видимо, в физиологических условиях ф.Х1 в основном активируется тромбином. ф.Х1 довольно устойчив к инактивации ингибиторами и имеет длительный период полувыведения. Образовавшись в достаточном количестве, ф.Х1 увеличивает количество активного ф.1Х, за счет чего соответственно значительно возрастает концентрация тромбина, который в свою очередь активирует по механизму положительной обратной связи ф.1Х, -VIII и -V. В то же время избыток тромбина тормозит начало процесса фибри-
Рис. 40. Внутренний каскад активации плазменного гемостаза. Начинается с взаимной активации контактных факторов системы гемостаза, Фактор XIIа переводит фактор XI в ХIа. Фактор ХIа активирует фактор IX. Все последующие этапы активации свертывания по внутреннему пути требуют ионов Са2+ и зависят от присутствия фосфоли-пидов. Фактор IХа активирует фактор X, но эта реакция не очень эффективная. Однако появившийся тромбин активирует фактор VIII. Активный фактор Villa вместе с фактором IХа, ионами Са2+ и фосфолипидами очень эффективно активирует фактор Ха, Обратная связь поддерживает развитие процесса за счет активации тромбином ф.VIII, -IX и -V
Плазменные белки гемостаза
нолиза за счет активируемого тромбином ингибитора фибринолиза (TAFI). Ингибитор С1-компонента комплемента (С1-ингибитор) является элементом системы контактной активации. Помимо комплемента, он ингибирует ф.ХIIа (см. раздел «Ингибиторы системы свертывания крови»). Другим ингибитором процесса контактной активации в физиологических условиях является апротинин. Рис. 41. Теназный и протромбиназный комплексы. Образование этих комплексов сопровождается резким увеличением активации соответственно фактора X и протромбина (фактор II) Конечный этап свертывания плазмы - образование фибринового сгустка Конечная стадия каскада свертывания плазмы заключается в образовании из растворимого плазменного белка фибриногена нерастворимого фибрина под воздействием тромбина и ф.ХIII (рис. 42).
Рис. 42. Последовательные стадии образования нерастворимого фибрина из растворимого фибриногена Тромбин Тромбин - ключевой фермент гемостаза. Тромбин - витамин-К-зависимый белок - является сериновой протеазой. В печени происходит синтез неактивного предшественника протромбина, который в дальнейшем циркулирует в плазме. В комплексе ф.Ха-Va-II на фосфолипидной поверхности происходит ограниченный протео-лиз протромбина. Образуется несколько активных структур с уменьшающейся молекулярной массой - мезотромбин, α-тромбин, β - тромбин, γ-тромбин. Наиболее значимым продуктом является сериновая протеаза - α-тромбин. На мо- лекуле тромбина имеется, по крайней мере, 4 сайта связывания для субстратов, ингибиторов, кофакторов и иона кальция. Это, а также способность тромбина активно функционировать не только на твердой фазе, но и в токе крови позволяет ему выполнять многочисленные функции. Важнейшие функции тромбина в гемостазе: • Ограниченный протеолиз фибриногена до • Активация ф.V, -VIII, -VII, -XI. • Активация тромбоцитов. • В комплексе с тромбомодулином тромбин • Активация ф.ХIII. • Ограниченный протеолиз плазматической • Стимуляция выброса из эндотелиоцитов тка Плазменные белки гемостаза Косвенным подтверждением важности тромбина для организма может служить тот факт, что известны лишь единичные описания пациентов с гомозиготным дефектом молекулы тромбина, а пациенты с гипопротромбинемией встречаются чрезвычайно редко. Важнейшим ингибитором тромбина является антитромбин III. Несколько меньшую роль играет кофактор гепарина П. Фактор XIII Фактор XIII - трансглютаминаза. В плазме большая часть неактивного ф.ХIII связана с фибриногеном. Активация ф.ХIII происходит путем ограниченного протеолиза неактивного ф.ХIII тромбином одновременно с отщеплением пептида А от фибриногена. Как и большинство других ферментов, он выполняет несколько функций в гемостазе: • Стабилизирует фибриновый сгусток путем • Участвует в связывании, α-ингибитора плаз- • Значительную роль ф.ХIII играет в процес • Обнаружены перекрестные реакции ф.ХIII с ф.ХIII участвует в процессах образования соединительной ткани, репаративных реакциях: • Участвует в связывании молекул фибронек- • Играет роль в биосинтезе коллагена, катали крови и образовывать прочную объемную структуру, которая эффективно закрывает повреждение сосуда и предотвращает потерю крови. Концентрация фибриногена в крови здорового человека значительно выше, чем концентрация других белков гемостаза, что связано с его уникальной ролью. Синтез фибриногена происходит в печени и не зависит от витамина К. Некоторое количество фибриногена синтезируется в мегакариоцитах и содержится в тромбоцитах. Этот фибриноген несколько отличается от фибриногена, синтезированного в печени. Помимо гепатоцитов и мегакариоцитов, активность гена γ-цепей фибриногена обнаружена в некоторых других тканях - головном мозге, легких, костном мозге, где γ-цепи фибриногена, видимо, выступают в роли молекул адгезии. Фибриноген - большой многокомпонентный белок, который состоит из трех пар полипептидных цепей - 2α, 2β, 2γ, связанных между собой дисульфидными мостиками и переплетенных друг относительно друга (рис. 43). Пространственная структура молекулы фибриногена состоит из центрального Е-доме-на и 2 периферических D-доменов. α- и β-цепи формируют глобулярные структуры - фибрино-пептиды А и В (ФПА и ФПВ), которые закрывают комплементарные участки в фибриногене и не позволяют этой молекуле полимеризовать-ся. Процесс взаимодействия фибриногена и тромбина происходит в жидкой фазе - кровотоке. Тромбин соединяется с фибриногеном и отщепляет конечные последовательности от α- и β-це-пей - 2 ФПА и 2 ФПВ (рис. 44). Образуются ра-
Фибриноген. Формирование гемостатического тромба Фибриноген - уникальная молекула, обладающая свойством быстро полимеризоваться в токе Рис. 43. Фибриноген состоит из 3 парных белковых молекул α, β и γ, Фибринопептиды А и В (ФПА и ФПВ) отщепляются тромбином от фибриногена, инициируя тем самым процесс полимеризации и превращение фибриногена в фибрин Плазменные белки гемостаза
Рис. 44. Формирование фибрин-мономеров из фибриногена. Тромбин отщепляет фибринопептиды ФПА и ФПВ от молекулы фибриногена, тем самым образуются растворимые мономеры фибрина, которые способны полимери-зоваться до линейного полимера, или «растворимого фибрина» створимые мономеры фибрина. В дальнейшем происходит спонтанное соединение комплиментарных участков фибрин-мономеров. Сначала образуются димеры, далее олигомеры и в конечном итоге собираются мононити полимери-зованного фибрина. Таким образом, фибрино-вая цепь формируется спонтанной, конец в конец полимеризацией фибрин-мономеров, при которой концевая часть одного мономера взаимодействует с центральной частью другого мономера в месте отщепления ФПА. Результатом такой полимеризации является линейный полимер шириной в 2 молекулы (рис. 44). На этом этапе фибрин легко растворим в 5-молярной мочевине, поэтому он получил название растворимого фибрина. Соединяясь с фибриногеном, тромбин не только отщепляет фибринопептиды. но и активирует связанный с ним фактор XIII. Фактор ХIIIа образует ковалентные связи между γ-цепями (D-доме-нами) нитей растворимого фибрина (рис. 45), которые соединяются за счет образования пептидных мостиков между боковыми радикалами лизина и глютамина. Сшитые между собой мононити фибрина образуют прочную сеть, менее подверженную фибринолизу и более устойчивую к механическим воздействиям. В такой форме фибрин не растворяется в 5-молярной мочевине и называется нерастворимым фибрином.
Образовавшийся фибриновый сгусток - трехмерная молекулярная сеть, в которую включены тромбоциты, эритроциты и лейкоциты (рис. 46). Активированные тромбоциты, связанные с нитями фибрина через рецепторы GPIIb-IIIa, сокращают-
Рис. 45. Образование нерастворимого фибрина под влиянием фактора ХIIIа
Плазменные белки гемостаза ся под действием тромбостенина (тромбоцитарно-го актомиозина) вследствие присущих им контрак-тильных свойств (см. главу «Тромбоциты»). Происходит ретракция сгустка крови. Сгусток уплотняется, из него выдавливается часть сыворотки. Формирование окончательного тромба наступает на 10-15-й минуте после полимеризации фибрина. Если тромбоциты отсутствуют или имеют дефект GPIIb-IIIa, то ретракции кровяного сгустка не происходит и он быстро лизируется в процессе фибринолиза. При отсутствии ретракции тромба в сосудистом русле возможен отрыв тром-ботических масс и эмболия удаленных сосудов (тромбоэмболия).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 428; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.019 с.) |







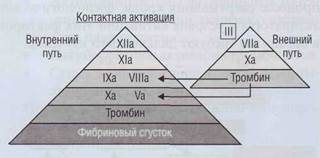


 Внутренний путь активации свертывания начинается с активации контактных факторов коа-гуляционного каскада: ф.ХII, прекалликреина и высокомолекулярного кининогена.
Внутренний путь активации свертывания начинается с активации контактных факторов коа-гуляционного каскада: ф.ХII, прекалликреина и высокомолекулярного кининогена.










