Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Антигепариновый фактор тромбоцитов (фактор 4 тромбоцитов, ф.4, PF4)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
PF4 является специфическим тромбоцитар-ным белком. PF4 синтезируется в мегакариоци-тах, хранится в α-гранулах, высвобождается после стимуляции тромбоцитов агонистами агрегации. Физиологическая роль PF4: • Нейтрализация гепарина. Связывая с высо • Хемотаксис нейтрофилов и моноцитов. • Активация фибробластов. • Проагрегантная функция. • Нейтрализация коллагеназы. На С-конце PF4 находятся две пары лизино-вых остатков, которые важны для соединения фактора с гепарином и нейтрализации последнего. Один тетрамер PF4 может соединяться с 1 молекулой гепарина низкой молекулярной массы (<10 кДа) и с 2 и более молекулами гепарансуль-фатов высокой молекулярной массы. Конкурентное связывание гепарансульфатов с PF4 нарушает его взаимодействие с антитромбином, ингиби- рует стимуляцию антитромбина PF4. Это ведет к снижению активности антитромбина и способствует формированию тромба. PF4 способен подавлять коллагеназу. При врожденной недостаточности ос-гранул тромбоцитов и мегакариоцитов - синдроме серых тромбоцитов - на поздних стадиях этого заболевания происходит развитие фиброза. Это, вероятно, является следствием избыточной активности коллагеназы. $-тром6оглобулин ф-ТГ, (З-TG - белок а-гранул тромбоцитов, обладает выраженной хемотаксическои активностью по отношению к лейкоцитам. Его освобождение из тромбоцитов опосредовано циклооксигеназ-ной реакцией и происходит до секреции других белков. После активации тромбоцитов освобождение из них β-TG и PF4 происходит в эквимолярных концентрациях. Однако PF4 быстро элиминируется из плазмы, связываясь с гликозаминоглика-нами, а β-TG относительно долго циркулирует, выделяясь через почки. Поэтому уровень в плазме β-TG в 3-6 раз выше, чем PF4. Влияние быстрой элиминации PF4 сохраняется и в патологических ситуациях, когда наблюдается значи- Тромбоциты гельное повышение β-TG и увеличение отношения (3-TG/PF4 (табл. 4). Таблица 4 Содержание β -тромбоглобулина и фактора 4 тромбоцитов в плазме при патологии
Здесь и далее: Н - норма, t - увеличено, Tt - значительно увеличено, I - снижено. У больных с тромбоцитопенией и тромбоци-тозом необходимо рассматривать уровень (3-TG и PF4 с учетом количества циркулирующих тромбоцитов. По отношению к числу тромбоцитов концентрация тромбоцитарных факторов в плазме повышена при ДВС-синдроме и при тромбо-тической тромбоцитопенической пурпуре, хотя абсолютные значения этих показателей могут быть в пределах нормальных значений. Фактор роста тромбоцитов (PDGF) PDGF синтезируется мегакариоцитами, в тромбоцитах содержится в α-гранулах. Каждая клетка содержит порядка 1000 молекул PDGF. Фактор является сильным стимулятором репарации поврежденных тканей. В сосудистой стенке рецепторы к PDGF присутствуют на фибробластах и гладких мышечных клетках; PDGF стимулирует пролиферацию этих клеток, а также усиливает продукцию гликозами-ногликанов, коллагена и других элементов соединительной ткани. В настоящее время установлено, что рецепторы к PDGF имеются в клетках лимфо-идной (Т-лимфоциты) и миелоидной линии. Нарушение хранения PDGF в мегакариоци-тах костного мозга может быть причиной развития фиброза, в том числе сопровождающего мие-лопролиферативные заболевания. Некоторые опухолевые клеточные линии могут продуцировать PDGF, в частности остеосаркома, гепатома, некоторые карциномы, опухоли костного мозга. [3-цепь PDGF имеет характерные черты для основной структуры вируса саркомы. В связи с этим PDGF является важной составляющей сложных влияний тромбоцитов на онкогенез. Фибриноген Фибриноген α-гранул тромбоцитов составляет примерно 3% от плазменного пула, однако роль его в агрегации тромбоцитов, по-видимому, сопоставима со значением плазменного фибриногена. Тромбоциты получают фибриноген из ме-гакариоцитов, которые, в свою очередь, захватывают плазменный фибриноген, синтезированный гепатоцитами, или синтезируют определенное количество фибриногена de novo. Поэтому даже отмытые тромбоциты образуют агрегаты, включающие молекулы фибриногена. У больных с семейной афибриногенемией основным источником фибриногена являются тромбоциты. Фактор V Фактор V α-гранул тромбоцитов - коагуля-ционный белок, синтезируемый в мегакариоци-тах. Иммунологически фактор V тромбоцитов схож с фактором V плазмы, формирующим с фактором X протромбиназный комплекс. На долю фактора V тромбоцитов приходится 18-25% этого белка крови человека, однако его влияние на формирование протромбиназного комплекса весьма существенно. Описан врожденный геморрагический диатез, при котором единственным нарушением было наличие неактивной формы тромбоцитарного фактора V. Введение протромбиназного комплекса, сформированного из плазменных факторов, не корригировало геморрагических проявлений. Фактор XIII Фактор XIII - трансглютаминаза, участвующая в стабилизации фибринового сгустка и
Тромбоциты формировании соединительной ткани. Все количество ф.ХШ распределяется примерно поровну между плазмой и тромбоцитами. Большая часть тромбоцитарного пула находится в цитоп- лазме клеток. Тромбоцитарный ф.ХШ синтезируется мегакариоцитами, плазменный пул - тканевыми макрофагами печени и гемопоэтических тканей. Функция тромбоцитов
Основными функциями тромбоцитов являются: • формирование первичной тромбоцитарной • катализ гуморальных реакций гемостаза за а) предоставления фосфолипидной поверх б) выброса прокоагулянтов из пулов хране • ретракция сгустка крови; • стимуляция локальной вазоконстрикции, ре Формирование первичной тромбоцитарной пробки в зоне повреждения сосудов возникает вследствие процесса, который можно условно разделить на 3 стадии: • 1 - адгезия тромбоцитов к субэндотелиаль- • 2 - активация этих тромбоцитов с выбросом • 3 - агрегация тромбоцитов. Адгезия тромбоцитов На рис. 22 показаны адгезированные тромбоциты на участке деэндотелизации. Через несколько минут после повреждения сосудистой стенки формируется сплошной слой адгезиро-ванных и агрегированных тромбоцитов, которые являются основой тромбоцитарного тромба (рис. 23). В процессе адгезии важную роль играют 2 механизма. Один из них - непосредственная адгезия тромбоцитов через рецепторы GPIa-IIa и GPVI к коллагену субэндотелия. Однако это взаимодействие недостаточно для удержания тромбоцитов в местах воздействия высоких скоростей кровотока - артериях и артериолах. Другой ме-
Рис. 22. Адгезированные тромбоциты на поврежденной (деэндотелизированной) сосудистой стенке Рис. 23. Тромбоцитарный тромб, сформированный на поврежденной сосудистой стенке
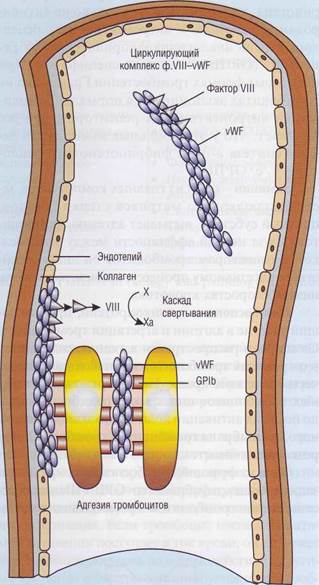
Тромбоциты ханизм, эффективно удерживающий тромбоциты привысокой скорости кровотока, включает адгезию тромбоцитов, опосредованную молекула-ми адгезии - фактором Виллебранда, фибронек-тином, витронектином, ламинином, тромбоспон-дином и др. In vivo оба эти механизма работают параллельно. Возможно, что первичный контакт тромбоцитов с субэндотелием осуществляется благодаря первому механизму, тогда как окончательная фиксация тромбоцитов происходит за счет формирования связей субэндотелий - фак-тор Виллебранда - GPIb-V-IX и связей, опосредованных другими молекулами адгезии. Молекулы адгезии Фактор Виллебранда (vWF) - один из самых больших гликопротеидов плазмы, имеет молекулярную массу от 540 до нескольких тысяч кДа, содержит в цепочке более 2000 аминокислот. Ген фактора Виллебранда находится на коротком плече 12-й хромосомы. Синтез фактора Виллебранда происходит в эндотелиоцитах и мегака-риоцитах. Фактор Виллебранда из эндотелиоци-гов секретируется или в плазму, или в субэндоте-лиальное пространство; кроме того, он может содержаться в тельцах Вейбла-Палада эндотелиоци-тов (пулы хранения) и секретироваться после стимуляции эндотелиальных клеток. Фактор Виллебранда, синтезированный мегакариоцитами, содержится в альфа-гранулах тромбоцитов. Информация о синтезе фактора Виллебранда получена в основном при изучении его в культурах эндотелиальных клеток. Первичный продукт синтеза, обозначаемый как пpe-пpo-vWF, найден в эндотелии и тромбоцитах, он иммуно-логически отличается от зрелого фактора Виллебранда. Его уровень снижен у пациентов с болезнью Виллебранда. Пре-про-vWF содержит 2813 аминокислотных остатков. В эндоплазматическом ретикулу-ме после гликозилирования npe-npo-vWF преобразуется в пpo-vWF, который превращается в зрелый vWF после отщепления пептида, состоящего из 741 аминокислотного остатка. Этот полипептид идентифицируется как антиген II vWF (vWF:AgII). Процесс димеризации и полимеризации vWF происходит одновременно. Зрелая субъединица vWF содержит 2050 аминокислотных остатков, 169 из которых - цистеин, сгруппированный в областях, расположенных в амино- и карбокси-концах молекулы (N- и С-концы). Процесс димеризации связан с образованием дисульфидных мостиков между С-концами молекулы, а дальнейшая полимеризация происходит за счет образования дисульфидных связей между N-концами. Конечный продукт накапливается в тельцах Вейбла-Палада в эндотелиоцитах и в α-гранулах тромбоцитов. Фактор Виллебранда состоит из ряда полимеров прогрессивно увеличивающейся молекулярной массы: разделяют легкие, средние, тяжелые и сверхтяжелые мультимеры. Молекулярная масса vWF варьирует от 540 кДа у димеров до 20 тысяч кДа у самых крупных мультимеров, содержащих от 50 до 100 субъединиц. Самым большим тромбоген-ным потенциалом обладают молекулы vWF с наибольшей молекулярной массой. В плазме нет мономеров фактора Виллебранда, он всегда образует комплексы. Концентрация vWF в плазме составляет примерно 10 мкг/мл. При исследовании vWF, содержащегося в пулах хранения, было выявлено, что его молекулярная масса, а следовательно, и тромбогенный потенциал существенно выше, чем у vWF, содержащегося в плазме, и наиболее высок в а-гранулах тромбоцитов (так называемый сверхвысокомолекулярный фактор Виллебранда). После сильной стимуляции тромбоцитов и эндотелиоцитов сверхвысокомолекулярный фактор Виллебранда некоторое время обнаруживается в плазме. Однако потом в сосудистом русле молекулярная масса vWF довольно быстро снижается до «нормальной» под воздействием кальпаиновых про-теаз плазмы. Такое распределение позволяет создавать высокий тромбогенный потенциал в местах повреждения эндотелия при выбросе vWF из пулов хранения, в то же время сохраняя тромбогенный потенциал на «обычном» уровне в интак-тном сосудистом русле. Фактор Виллебранда имеет два пути секреции: непосредственная секреция после синтеза и полимеризации, которая создает определенный уровень vWF в крови, и регуляторная секреция из пулов хранения в ответ на различную стимуляцию. Фоновая активность vWF в крови у каждого человека может меняться в значительных
Тромбоциты
пределах. Реализация vWF из тромбоцитарных гранул возникает при активации тромбоцитов под воздействием различных физиологических и нефизиологических индукторов (АДФ, коллаген, адреналин, вазопрессин, серотонин, тромбин, простагландин Е1, тромбоксан А2 и др.), и в том числе плазменного vWF. Уровень vWF в крови возрастает при воспалении различного генеза, повреждении эндотелия сосудов при васкулитах, стрессе, у женщин во время беременности. Повышение активности vWF в патологических ситуациях может способствовать развитию тромбозов. Вторичные изменения структуры vWF и его активности являются следствием иммунных процессов, тромботической тромбоцитопенической пурпуры, гемолитико-уремического синдрома и др. Описаны заболевания (болезнь Виллебран-да, тип Виченза; врожденная тромботическая тромбоцитопеническая пурпура), при которых дефект этих ферментов приводит к накоплению сверхвысокомолекулярных мультимеров vWF и преждевременной секвестрации тромбоцитов из кровотока. Основными функциями фактора Виллебранда являются: • опосредование адгезии тромбоцитов к субэн- • связывание свободного фактора VIII и защи Опосредование адгезии и агрегации тромбоцитов. Роль фактора Виллебранда в адгезии и агрегации тромбоцитов наиболее велика в условиях воздействия высоких скоростей кровотока. Молекулы vWF специфически связываются с рецепторами тромбоцитов GPIb-V-IX и коллагеном субэндотелия. Это обеспечивает прочную фиксацию тромбоцитов к субэндотелиальным структурам в тех участках сосудистого русла, где сила потока крови существенно мешает формированию гемостатической пробки и другие механизмы адгезии не могут обеспечить надежной фиксации тромбоцитов. В частности, известно, что vWF является ключевым при формировании тромба в мелких артериях, артериолах и артериальных капиллярах. В местах, где интенсивность кровотока невелика, роль vWF уменьшается, преобладающим становится взаимодействие, опосредованное другими молекулами, в том числе прямая адгезия тромбоцитов к коллагену посредством GPIa-IIa. Агрегация тромбоцитов в условиях воздействия активного тока крови тоже происходит с участием фактора Виллебранда. Помимо GPIb-V-IX, с фактором Виллебранда также связывается GPIIb-IIIа. Возможно, что это взаимодействие является ключевым в процессе агрегации в местах сосудистого русла с высокой скоростью тока крови. Тест агрегации, опосредованный фактором Виллебранда, в лабораторных условиях может быть выполнен с использованием фиксированных тромбоцитов. Видимо, эта реакция не требует энергетических затрат. Однако стимуляция рецептора Ib-V-IX приводит к активации тромбоцита. Учитывая особенности фактора Виллебранда, можно сказать, что он выполняет функцию «биологического клея», фиксируя тромбоциты на поврежденной сосудистой стенке (рис. 24). Другая функция фактора Виллебранда - защита ф.VIII от протеолитической деградации системой протеин С - протеин S. В плазме vWF является белком-носителем фактора VIII.
Рис. 24. Фактор Виллебранда (vWF) выполняет роль «биологического клея», прикрепляя к коллагену субэндотелия адгезированные тромбоциты через гликопротеиновый комплекс GPIb-V-IX, Тромб увеличивается в размерах по мере адгезии и агрегации новых тромбоцитов, скрепление которых в агрегат обеспечивает фибриноген, имеющий дива-лентную структуру и взаимодействующий с рецепторами GPIIb-llla Тромбоциты Молярная концентрация vWF примерно в 50 раз выше, чем молярная концентрация фактора VIII. Фактор VIII практически весь связан с vWF (рис. 25). Это предупреждает быструю деградацию ф.VШ под влиянием протеина С. Связанный с vWF фактор VIII защищен от протео-литической инактивации в плазме, поскольку у него заблокированы сайты связывания с фос-фолипидной матрицей и заблокированы сайты связывания с протеином С. Поэтому недостаток vWF часто вызывает вторичный дефицит ф.VIII. В области повреждения сосуда, в процессе vWF-опосредованной адгезии тромбоцитов происходит контакт комплекса vWF-ф.VIII и тромбина (ф.Па), который активирует ф.III, освобождая его из комплекса с фактором Виллебранда. Фибронектин (плазматический, субэндоте-лиальный и тромбоцитарный) - гранулярный контактный белок, который способен образовывать комплексы с GPIc-Па-рецепторами тромбоцитов и коллагеном. Сродство фибронектина к коллагену и тромбоцитам меньше, чем у фактора Виллебранда, однако молекулярная концентрация его выше. Видимо, фибронектин является основной молекулой адгезии в венозной и капиллярной сети, образуя ось: тромбоцитарный рецептор GPIc-IIa - фибронектин - коллаген. Гликопротеиновый комплекс GPIc-IIa распознает в фибронектине RGD последовательность и осуществляет рецепторную функцию как в интактных, так и в активированных тромбоцитах. Характерная аминокислотная последовательность RGD - трипептид Arg-Gly-Asp имеется во всех адгезивных белках крови, белках а-гранул тромбоцитов, фибриногене, факторе Виллебранда, фибронектине, витронектине и других белках. Наличие RGD-последовательно-сти на фибронектине определяет зависимость процесса его взаимодействия со своим рецептором на тромбоцитах от двухвалентных катионов Са2+ и Mg2+. Витронектин - гликопротеин плазмы, субэндотелия и а-гранул тромбоцитов. Имеет значение в гемостатических реакциях и в восстановлении поврежденных тканей сосудистой стенки. Витронектин, как и другие адгезивные белки, содержит трипептид RGD, распознающийся интегриновыми рецепторами эндотели-альных клеток и тромбоцитов. Витронектино-
Рис. 25. Комплекс фактор VIII - фактор Виллебранда (ф.Vlll—vWF) состоит из 2 отдельных белков, которые выполняют в гемостазе разные функции, имеют разную химическую и иммунологическую структуру. Фактор VIII необходим для активации фактора X в каскаде свертывания крови, его дефицит вызывает гемофилию А. Фактор Виллебранда (vWF) - полимерный белок, который составляет основную массу комплекса. Он необходим для адгезии тромбоцитов к поврежденной стенке сосудов, обеспечивая взаимодействие коллагена с гликопротеиновым комплексом тромбоцитов GPIb-V-IX. Кроме того, он участвует в агрегации тромбоцитов, взаимодействуя с интегринами GPIIb-llla. Недостаток vWF приводит к болезни Виллебранда
Тромбоциты
вый рецептор на тромбоцитах функционирует постоянно, что отличает его от рецептора фибриногена, который работает только на активированных клетках. У витронектинового рецептора р-цепь аналогична фибриногеновому рецептору (GPIIIa), но а-цепь специфична. При некоторых формах тромбостении Гланцмана на тромбоцитах экспонируется нормальное количество витронектиновых рецепторов, что доказывает, что у этих больных имеет место дефект синтеза а-цепи фибриногенового рецептора, т. е. GPIIb. Ламинин - один из главных компонентов эк-страцеллюлярного матрикса стенки сосудов, плотный субстрат, вызывает адгезию тромбоцитов. Из-за низкой аффинности между этим белком и рецептором тромбоцитов он лишь содействует адгезивному процессу, причем только при низких скоростях кровотока. Тромбоспондин - гликопротеин, принимающий участие в адгезии и агрегации тромбоцитов. Он широко распространен в тканях, содержится в α-гранулах тромбоцитов и в небольшом количестве в плазме крови. На поверхности интакт-ных тромбоцитов очень мало тромбоспондина, но после их активации количество экспонированного на мембране тромбоцитов тромбоспондина резко увеличивается. Одна из функций тромбоспондина - стабилизация комплекса фибриноген-GPIIb-IIIa в процессе агрегации тромбоцитов. Тромбоспондин увели- чивает его прочность и переводит агрегацию тромбоцитов из обратимой в необратимую (рис. 26). Помимо этого, тромбоспондин связывается с рядом коагуляционных факторов (тромбином, факторами IХа, Ха), что приводит к повышению их локальной концентрации и защищает от действия ингибиторов. Активация тромбоцитов При контакте рецепторов адгезии тромбоцитов с субстратом и под воздействием синтезированного в области повреждения сосуда тромбина начинается процесс активации тромбоцитов. Видимо, основную роль в первичной активации тромбоцитов играет сигнал с рецепторов GPIa-IIa, GPIb-V-IX и GPVI, которые контактируют со своими агонистами, в первую очередь с коллагеном, фактором Виллебранда и тромбином. Помимо коллагена, свойством активировать тромбоциты обладают и другие субэндоте-лиальные структуры. Активация тромбоцитов лежит в основе выполнения ими своих функций. В табл. 5 приведен список основных веществ, активирующих тромбоциты. Почти все эти вещества взаимодействуют с тромбоцитами через специфические рецепторы, которые были описаны выше. Несмотря на многообразие активаторов и большое количество рецепторов к ним, клетка имеет ограниченное количество путей передачи сигнала и эффекторных
Рис. 26. Взаимодействие рецепторов к фибриногену и тромбоспондину с соответствующими лигандами. При взаимодействии тромбоцитов с фибриногеном на первой фазе происходит их обратимая активация, При стабилизации комплекса тромбоспондином процесс переходит в необратимую стадию агрегации Тромбоциты Субстанции, стимулирующие тромбоциты Таблица 5
Данные приведены по: Kinlough-Rathbone R.L. D.E. MacJntyre, J.L. Gordon. Amsterdam, 1987. Mustard J.F. // Platelets in biology and pathology, III / Eds
механизмов. Реакция тромбоцита на активирующие воздействия однотипна: • Тромбоцит меняет форму (рис. 27): у него по • Меняются соотношения различных фосфоли- • На мембране тромбоцитов экспрессируются • Происходит секреция содержимого пулов • Тромбоциты фиксируются на поверхностях тивное состояние тромбоцит снова может активироваться и вступать во взаимодействие с другими клетками и структурами. Обратимая агрегация возникает при кратковременном воздействии слабого стимула. Если стимуляция длительная или сильная, происходит необратимая активация тромбоцита. В этом случае тромбоцит прочно фиксируется к другим клеткам или внеклеточным структурам, происходит полная дегрануляция и секреция содержимого пулов хранения. Если тромбоцит после необратимой активации поступает в ток крови, он не может в дальнейшем вступать во взаимодействие с другими клетками и быстро элиминируется из кровообращения. В случае массивного поступления в ток крови необратимо активированных тромбоцитов выявляется достоверное снижение агрегации тромбоцитов со всеми индукторами. Микроскопия в этом случае позволяет выявить большое количество деформированных тромбоцитов. Стимуляторы тромбоцитов можно разделить на слабые и сильные. К слабым стимуляторам относятся АДФ, адреналин, вазопрессин, серотонин. Передача сигнала от рецепторов этих веществ проходит стадию усиления внутри клетки через дополнительный этап образования продуктов тромбоксано-вого завершения и секреции хранимых в грану-
Рис. 27. Стадии контактной активации тромбоцитов: А - неактивный тромбоцит (дискоцит, пластинка); Б - тромбоциты в обратимой стадии контактной активации (шаровидные формы с псевдоподиями); В - тромбоцит в необратимой стадии адгезии (распластанная форма без внутреннего содержимого - «тень тромбоцита») лах активных компонентов. При исследовании агрегации тромбоцитов в присутствии слабых стимуляторов на агрегатограммах кривая имеет двухступенчатую форму, что обусловлено усилением агрегации после выделения содержимого пулов хранения (рис. 28). Сильные стимуляторы тромбоцитов - коллаген, тромбин, большие дозы АДФ - непосредственно после мембранной стимуляции приводят к необратимой активации. В табл. 5 представлены наиболее важные активаторы тромбоцитов. Часть из них присутствует в подпороговых концентрациях в интактной плазме и избирательно накапливается в зоне повреждения сосудов; другие появляются в системе циркуляции при активации системы свертывания крови в физиологических или патологических условиях. Некоторые факторы выделяются из самих тромбоцитов (АДФ, серотонин, адреналино-подобные субстанции, фактор Виллебранда).
Рис. 28. Типы агрегатограмм. V пациентов при стимуляции агрегации адреналином в дозе 10 мкмоль/л в 83% случаев наблюдается двухфазная агрегация тромбоцитов, в 13% случаев - необратимая агрегация и в 4% - после начальной агрегации наблюдается дезагрегация (собственные данные) Агрегация тромбоцитов Процесс агрегации заключается в присоединении активированных тромбоцитов, находящихся в токе крови, друг к другу и ранее фиксированным в области повреждения. Основным рецептором агрегации является GPIIb-IIIa (интег-рин αIIbβ3). После активации тромбоцита GPIIb-IIIa значительно повышает свою аффинность по отношению к фибрину и меняет антигенную структуру (что свидетельствует о значительных кон- формационных изменениях). После этого происходит соединение тромбоцитов, опосредованное фибрином и фактором Виллебранда (рис. 24). Вследствие распространения активирующего сигнала на агрегированные тромбоциты, удаленные от места повреждения, образуется толстый слой тромбоцитов, армированный фибрином. Этот процесс лежит в основе образования тром-боцитарного тромба. По мере удаления от зоны Тромбоциты повреждения концентрация агонистов активации и агрегации тромбоцитов снижается и соответственно уменьшается активация тромбоцитов. Дистально расположенные частично активированные тромбоциты отрываются от сгустка и возвращаются в кровоток. Таким образом, периферическая дезагрегация тромбоцитов предотвращает неограниченный рост сгустка. Ретракция сгустка крови Ретракцией сгустка крови называют уплотнение сгустка с выделением из него избытка сыворотки. Ретракция способствует улучшению механических характеристик сгустка и снижению ак- тивности фибринолиза внутри него. Ретракция сгустка связана с контрактильными свойствами тромбоцитов. Фибриллы миозина, расположенные в цитоплазме тромбоцитов, фиксированы к мембранному гликопротеину GPIIb-IIIa. В активированных тромбоцитах за счет миозина происходит процесс постепенного «сжимания» цитоплазмы, что приводит к уплотнению всего сгустка крови. При врожденной недостаточности GPIIb-IIIa -тромбастении Гланцмана - грубо нарушается ретракция сгустка крови. Следствием этого является не только грубый дефект тромбоцитарного гемостаза, но и качественный дефект образовавшегося сгустка крови.
Роль лейкоцитов в гемостазе РОЛЬ ЛЕЙКОЦИТОВ В ГЕМОСТАЗЕ
Лейкоциты (нейтрофилы и моноциты) в зоне повреждения сосуда участвуют в гемостатических реакциях. Участие нейтрофилов в пристеночном тромбообразовании Агрегация тромбоцитов сопровождается освобождением из α-гранул активаторного рецептора Р-селектина (CD62), который остается ассоциированным с плазматической мембраной тромбоцитов. Экспрессия на мембране лейкоцитов Р-селек-тин-связывающего гликопротеина-1 (PSGL-1) позволяет нейтрофилам присоединять тромбоциты (рис. 29). Связь нейтрофилов с тромбоцитами обеспечивает репаративные и воспалительные реакции, возникающие в ответ на повреждение. Нейтрофилы после связывания на мембранах способны секретировать адгезивные молекулы и интерлейкины. Некоторые из интерлей-кинов, в частности интерлейкин-1 (ИЛ-1) и фактор некроза опухоли-ос (ФНО-а), активируют эндотелиальные клетки. Первичный контакт гранулоцитов приводит к перемещению их вдоль сосудистой стенки с последующей транс-эндотелиальной миграцией в субэндотелий. При действии повреждающих факторов, таких, как иммунные комплексы, эндотоксин, гранулоци- ты могут дегранулироваться и освобождать ИЛ-1, ФНО-α, протеолитические ферменты, такие, как эластаза и катепсин, активные формы кислорода (О2-, О2+), что в свою очередь ведет к повреждению сосудистой стенки. Этот процесс доминирует при воспалительных реакциях. Протеолитические ферменты, которые освобождаются из лейкоцитов, в участках воспаления вызывают нарушения структуры и функции эндотелия, это является условием развития петехий. Роль нейтрофилов в модуляции реакций гемостаза требует уточнения. С одной стороны, экспрессия тканевого фактора на мембране нейтрофилов происходит либо при длительной стимуляции различными провоспалительными цитокинами, либо после длительного взаимодействия с Р-селектином активированных тромбоцитов. К этому времени на активированных тромбоцитах уже образуется сгусток крови. С другой стороны, экспериментально доказано моду-
Рис. 29. Участие активных нейтрофилов в повреждении сосудистого эндотелия Роль лейкоцитов в гемостазе лирующее воздействие лейкоцитов крови на функцию тромбоцитов при исследовании агрегации тромбоцитов в цельной крови. Кроме того, исследования показали возможность сборкина нейтрофилах протромбиназного комплекса. В последнее время описан феномен агрегации лейкоцитов (нейтрофилов) при ишемии тканей. Этот феномен особенно значим для повреждения легких при шоке. В развитии геморрагического шока он играет ведущую роль. На рис. 30 представлен агрегат из нейтрофилов, сформированный на поверхности сосудистой стенки.
Рис. 30. Агрегат из нейтрофилов, выделенный из сосудов легких, в которых формируются агрегаты при развитии респираторного дистресс-синдрома (РДС). Сканирующая электронная микроскопия
|
|||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 555; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.32.243 (0.014 с.) |