Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нефелометрические коагулометрыСодержание книги
Поиск на нашем сайте
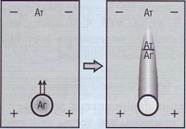
Нефелометрические коагулометры определяют момент образования сгустка по изменению рассеяния света. Новейшие разработки в этой области технологий нашли воплощение в коагу-лометрах фирмы «Sysmex» (Япония), в которых используется принцип определения сгустка по боковому рассеиванию света (рис. 87). Метод рассеивания обеспечивает высокое качество анализов - высокую специфичность и чувствительность метода детекции сгустка даже для сложной липе-мичной или иктеричной плазмы.
Обеспечение диагностики нарушений гемостаза в КДЛ
Рис. 86. Оптический двухканальный коагулометр KG-1 производства компании «Соrmау». Точность результатов повышается за счет синхронизации времени попадания реагента в измерительную кювету и запуска отсчета времени, а также исключения из применения магнитных мешалок в измерительных кюветах, Прибор эргономичен, термостат для проб и реагентов размещен в самом приборе, у кювет есть перемычки и держатели для удобства переноса из термостата в измерительные ячейки. Работа на приборе экономна, так как снижен расход реагентов за счет уменьшения объема кювет, использования многоразовых кювет Рис. 87. Нефелометрический принцип измерения светорассеяния, заложенный в основу определения момента выпадения сгустка на коагулометрах фирмы «Sysmex» (Япония). Метод позволяет повысить точность измерений и их воспроизводимость до 2-3%, а также снизить влияние на результат самого образца. Анализаторы работают на любых реагентах (в том числе на российских)
В табл. 15 указаны преимущества и недостатки автоматизированных коагулометров, использующих разные принципы регистрации выпадающего сгустка. Современные коагулометры сочетают в одном приборе несколько методов измерения, по- этому могут использоваться для комплексной оценки гемостаза. Так, фирма «Sysmex» предлагает серию коагулометров с разными возможностями и производительностью для любой клинико-диагностической лаборатории любого уровня исследования гемостаза (рис. 88).
Таблица 15 Преимущества и недостатки различных методов обнаружения сгустка
Обеспечение диагностики нарушений гемостаза в КДЛ
Амидолитические методы с использованием хромогенных и флуорогенных субстратов
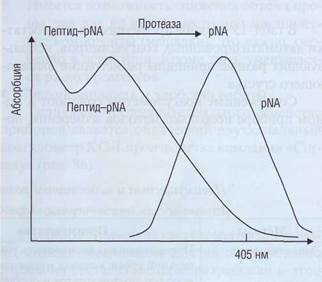
Применение синтетических хромогенных субстратов явилось прорывом при исследовании отдельных ферментов или ингибиторов, которые не учитываются простыми коагуляционными тестами или очень трудны для стандартизации. Во многих случаях хромогенные субстраты являются специфичными и позволяют определить протеолити-ческую активность отдельных компонентов плазменного гемостаза и их ингибиторов. Эти тесты схожи с тестами клинической химии, поэтому легко автоматизируются и могут выполняться на биохимических анализаторах как в клинико-диагностических, так и в научных лабораториях. Принцип тестов с хромогенными субстратами представлен на рис. 89. Протеаза расщепляет короткоцепочечный пептид (из 3-10 аминокислот), к которому через эфирную связь пришит хромоген (в нашем случае паранитроанилин -pNA). Комплекс пептид-pNA имеет максимум поглощения в области короткого ультрафиолета, свободный pNA - при 380 нм. Итоговая концентрация pNA пропорциональна активности протеазы и определяется по увеличению поглощения светового пучка с длиной волны 405 нм.
Рис. 89. Принцип определения активности протеолити-ческого фермента (протеазы) с использованием хро-могенного субстрата. Максимум поглощения паранитро-анилина, связанного с пептидом, находится в области короткого ультрафиолета, а свободного паранитроанилина -380 нм, При длине волны 405 нм поглощает практически только свободная форма хромогена, на этой длине волны проводится регистрация протеолитической реакции Обеспечение диагностики нарушений гемостаза в КДЛ Для оценки активности факторов гемостаза стали использовать флуорогенные субстраты, в частности 7-амино-4-метилкумарин (АМК), который имеет максимум эмиссии при 440 нм. Флуорогенные субстраты обладают большей аналитической чувствительностью и позволяют измерить специфическую активность компонентов гемостаза в большем диапазоне, чем хромогенные субстраты. Они могут использоваться для определения компонентов гемостаза, присутствующих в плазме в следовых концентрациях или обладающих относительно низкой активностью. Преимущества использования хромогенных и флуорогенных субстратов: • Высокая чувствительность метода. pNA или • Высокая специфичность. Для каждой отдель неспецифическими аминопептидазами. Кроме того, в тестах используется концентрация хромогенных субстратов в несколько сотен мкмоль/л, что существенно выше, чем константа Михаэлиса (Км) соответствующих ферментов, поэтому скорость реакции не зависит от концентрации субстратов. Факторы, которые необходимо учитывать при использовании хромогенных субстратов в практической клинико-диагностической лаборатории: • Растворимость субстратов должна быть хо • Реакция должна быстро достигать линей • В пробе не должно быть мутности, которую Недостатки метода с использованием хромогенных субстратов: • Высокая стоимость реактивов. • Возможное завышение результатов при иссле
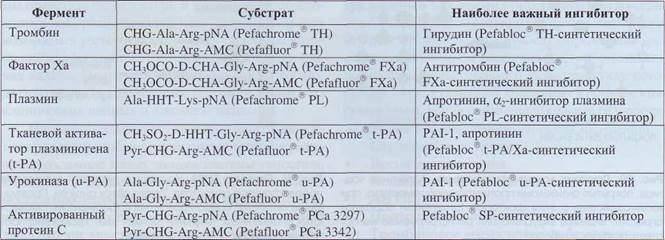
Таблица 16 Типичные хромогенные и флуорогенные субстраты и ингибиторы, применяемые для выявления активности протеолитических ферментов системы гемостаза
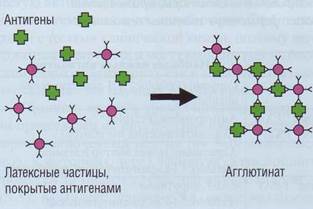
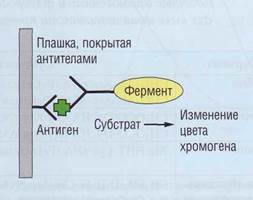
Обеспечение диагностики нарушений гемостаза в КДЛ Иммунохимические методы Иммунохимические методы активно начали внедряться в клинико-диагностических лабораториях с целью исследования гемостаза в последнее десятилетие. Они позволяют количественно определять концентрацию конкретного белка, что отличает их от коагуляционных методов и методов с хромогенными субстратами, в которых определяется функциональная активность компонентов, а не их концентрация. Первые тест-системы не позволяли различить активные и неактивные (профакторы) компоненты системы гемостаза. В последнее время предлагается все больше тест-систем для определения концентрации активных компонентов свертывания, их кофакторов, активаторов, ингибиторов, продуктов про-теолитического гидролиза, а также сформировавшихся субстрат-ферментных комплексов. Эти тесты основаны на использовании специфических антител. В современных клинико-диагностических лабораториях доступными стали иммунохимические методы для ручного и автоматизированного использования, основанные на латекс-агглютинации (рис. 90) и методе ELISA (Enzyme-Linked ImmunoSorbent Assay). Латекс-агглютинация Латекс-агглютинация выявляется визуально или на автоматизированных нефелометрах. Не- достатком этого подхода является нелинейность оптического сигнала при турбидиметрическом и нефелометрическом методах регистрации. Метод ELISA Метод ELISA (рис. 91) для выявления концентрации факторов гемостаза, как правило, использует принцип «сендвича». На стенки микроплашки наносятся антитела к исследуемому фактору гемостаза (твердая фаза). После добавления плазмы происходит осаждение специфического антигена (белка системы гемостаза) на фиксированных антителах. Плашка промывается и заполняется вторичными антителами, взаимодействующими с этим же белком, но по другим эпитопам (антигенным структурам). Вторичные антитела конъюгированы с ферментом (ELISA), радиоактивной меткой (РИА), люминесцентной меткой (ЛИА). В тесте ELISA после отмывки несвязавшихся антител добавляется субстрат ферментативной реакции и хромоген. Изменение светопропускания раствора пропорционально количеству антигена (фактора), осажденного на фиксированных антителах. Методика позволяет оценить этот параметр количественно в концентрации <1 нг/мл, что достаточно для многих компонентов свертывающей системы.
Рис. 90. Принцип латекс-агглютинации. Латексные частицы, покрытые антителами против фактора гемостаза, при взаимодействии с этим фактором (антигеном) образуют агрегаты, видимые визуально или регистрируемые на соответствующих приборах Рис. 91. Принцип ELISA. На плашке, покрытой антителами против фактора гемостаза, связывается антиген, Проявляющие антитела, конъюгированные с ферментом, связываются с антигеном. Фермент меняет цвет хромогена пропорционально количеству антигена
Обеспечение диагностики нарушений гемостаза в КДЛ В настоящее время значительное развитие получают быстрые качественные и полуколичественные иммунохимические иммунодиффузион-ные методы, основанные на визуальном определении реакции антиген-антитело. Радиальная иммунодиффузия Метод радиальной иммунодиффузии (РИД) основан на образовании колец преципитации в результате взаимодействия специфических антител, содержащихся в геле, с анализируемым антигеном, помещаемым в углубления стандартного размера (рис. 92). В результате диффузии в геле растворимых антигенов кольцо преципитации образуется в зоне оптимального соотношения антиген/антитело. Площадь, ограниченная кольцом преципитации, пропорциональна количеству антигена. «Ракетный» иммуноэлектрофорез «Ракетный» иммуноэлектрофорез - иммунологический метод, сочетающий в себе электрофорез и иммунодиффузию (рис. 93). Метод дает возможность различить сходные по электрофоретической подвижности вещества с помощью специфической реакции преципитации между антигеном, помещаемым на гелевую (целлюлозо-ацетатную) пластинку, и соответствующими антителами, которые содержатся в ней. Длина «ракетных» иммунопреци-питатов пропорциональна концентрации антигена. Метод довольно прост в исполнении и обладает относительно высокой точностью. При фундаментальном подходе к исследованиям компонентов гемостаза применение флуоресцентной или люминесцентной меток повышает чувствительность иммунохимических методов и расширяет спектр определяемых компонентов.
Рис. 92. Принцип метода радиальной иммунодиффузии, используемый для полуколичественной оценки неко- Рис. 93. Принцип метода «ракетный» иммуноэлектро- торых факторов гемостаза форез Скрининговые тесты оценки плазменного звена гемостаза Лабораторная диагностика нарушений системы гемостаза является одной из самых дорогостоящих в лабораторной практике. Выполнение всех возможных тестов для уточнения характера нарушений для всех пациентов - практически недоступная задача. Поэтому чрезвычайно важно соблюдать этапность проведения тестов, исходить из клинических данных и анамнеза пациента. На первом этапе для уточнения направленности нарушений необходимо провести тесты, отражающие состояние целых звеньев системы гемостаза. Поскольку в разных лабораториях при анализе гемостаза преследуются разные цели, перечень тестов, входящих в гемостатический скрининг для данной лаборатории, может отличаться от такового в дру- гих лабораториях. Однако существует набор тестов, традиционно называемых (и рекомендуемых) скри-нинговыми для диагностики состояния системы гемостаза. Обычно к ним относят определение времени кровотечения и несколько тестов, оценивающих состояние плазменного звена гемостаза, которые входят как основной компонент в понятие коа-гулограммы. Наиболее полно этапность разработана для диагностики геморрагических нарушений. Скрининговые тесты: • Время кровотечения. • Количество тромбоцитов. • АЧТВ. • Протромбиновое время (по Квику). • Тромбиновое время и/или фибриноген.
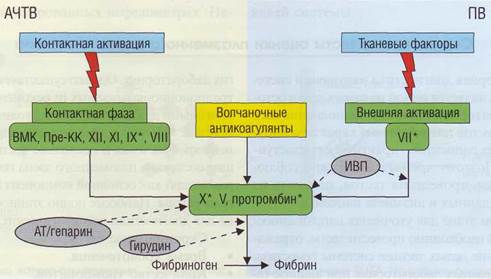
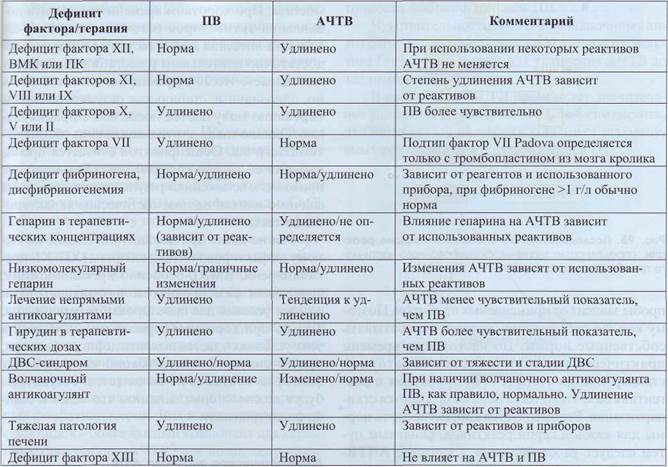
Обеспечение диагностики нарушений гемостаза в КДЛ Для пациентов с тромботическими заболеваниями адекватного скрининга для диагностики нарушений системы гемостаза не разработано. Имеет смысл проведение исследования наиболее значимых маркеров тромбофилии, о которых будет говориться ниже. Однако есть возможность контроля активности самого процесса патологического тромбообразования на основе анализа концентрации маркеров тромбообразования. Скрининговые тесты на состояние внутреннего и внешнего каскада активации протромбиназы позволяют выявлять нарушения со стороны факторов-субстратов, кофакторов, ингибиторов каскада свертывания, а также действие некоторых лекарственных препаратов или аутоантител. Основным тестом на состояние внутреннего каскада свертывания плазмы является АЧТВ, на состояние внешнего каскада - ПВ. Их диагностическое значение представлено в табл. 17 и на рис. 94. Несмотря на то что в тестах АЧТВ и ПВ участвует большинство плазменных факторов, далеко не во всех случаях при патологии того или иного звена или действии лекарственных препаратов эти показатели меняются (табл. 18). Коагу-лограмма - это комплексный анализ по многим тестам, совокупность которых может позволить определить конкретную причину нарушения свертывания крови.
Таблица 17
· Концентрация фибриногена начинает влиять на результаты тестов при снижении ее ниже определенного порога. Как правило, эти тесты не позволяют количественно определить фибриноген или заподозрить умеренное снижение его концентрации.
Рис. 94. Факторы, влияющие на результаты скрининговых тестов АЧТВ и ПВ. Звездочкой зависимые факторы, на которые влияют антикоагулянты непрямого действия
Обеспечение диагностики нарушений гемостаза в КДЛ Таблица 18 Изменение А ЧТВ и ПВ при патологии отдельных компонентов плазменного звена гемостаза и влиянии некоторых лекарственных средств
В названии АЧТВ (иногда его обозначают как активированное парциальное тромбопластиновое время, АПТВ) слово «частичное», или «парциальное», указывает на то, что в тесте используются реагенты, содержащие фосфолипиды, а не тканевые факторы (в этом отличие от ПВ, где используется тканевой тромбопластин). Факторы и взаимные влияния некоторых из них на АЧТВ представлены на рис. 95. АЧТВ используется как скрининговый тест для оценки внутреннего каскада свертывания плазмы, скрининговой диагностики волчаночного антикоагулянта и слежения за антикоагулянт-ным действием гепаринов. АЧТВ - более значимый тест для первичного выявления патологии, чем ПВ, так как выявляет относительно часто встречающуюся гемофилию А и В (дефицит факторов VIII и IX соответственно) и наличие волчаночного антикоагулянта.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 495; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.013 с.) |




 Рис. 88. Коагулометры фирмы «Sysmex»
Рис. 88. Коагулометры фирмы «Sysmex»