
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Потенціометричний метод аналізу складу рідин.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Потенціометричний метод аналізускладу рідин досить поширений і має важливе значення під час визначання якості продукції і використовується у напрямках: -вимірювання концентрацій різних іонів у рідинах (іонометрія), наприклад, вимірювання кислих або лужних функцій розчину; - контролю окиснювально-відновного (редокс) потенціалу (редоксметрія), наприклад,визначення моменту нейтралізації розчинів при їхтитруванні. Кислотні або лужні властивості розчинів визначається по активності в них іонів водню [Н+]. Суть явищ, які використовується при потенціометричних методах аналізу, визначається електролітичною дисоціацією і зв’язаною з нею теорією електродних потенціалів. В потенціометрії для створення інформації про склад речовини використовують такі потенціали: електродний, що виникає під час занурення металевих електродів у розчин їхніх іонів; мембранний, що виникає на мембранах, які мають селективну проникність для одного типу іонів (напів-проникні мембрани) і які поділяють два однакові розчини, що містять ці іони в різних концентраціях; окиснювально-відновний (редокс-потенціал), який встановлюється на інертних металевих електродах, занурених у розчин окиснювально-відновних речовин; дифузійний, який виникає у місці контакту двох розчинів однієї й тієї ж речовини, що мають різну концентрацію, або між двома розчинами різних речовин. Явище виникнення поверхневого електродного потенціалу
де В свою чергу утворення іонів в розчинах пов’язане з явищем електролітичної дисоціації, яке властиве будь-якому розчину і зумовлене утворенням в розчині електроіонів: позитивних іонів (катіонів) і негативних іонів (аніонів).
Більшість хімічних процесів відбувається в водних розчинів. Чиста вода являє собою нейтральну речовину і вона слабо дисоціює з утвореннями катіонів водню [Н+] та аніонів гідроксилу [ОН-]: Н2О↔[Н+] + [ОН-]. Кислоти та луги у водних розчинах теж дисоціюють: кислоти на катіони водню та аніони кислотного залишку, а луги – на катіони металу і аніони гідроксилу: НСl ↔ [Н+] + [Cl-] NaOH ↔ [Na+] + [OH-]. У загальному випадку, визначаючи електродний та інші потенціали, замість поняття концентрації записати у вигляді: Між активністю
де Вимірювання поверхневого потенціалу електроду Але виміряти такий потенціал тільки між одним електродом і розчином не можливо, так як при під єднанні вимірювального приладу до розчину знову ж таки виникає потенціалів між розчином та провідником, який з’єднує розчин з приладом. І відповідно різниця потенціалів, яку повинен виміряти прилад, буде дорівнювати нулю. Поверхневий електродний потенціал вимірюють (рис.1,а) непрямим методом за електрорушійною силою (ЕРС) активного первинного вимірювального перетворювача, складеного з вимірювального електрода (лівий на рис.1,а) і допоміжного (правий на рис.1,а, його ще називають порівняльним чи опорним) електрода. Обидва електроди утворюють гальванічний елемент, який занурено в досліджувану рідину, наприклад, електроліт, що знаходиться у вимірювальній кюветі або протікає крізь неї. Потенціал вимірювального електрода Електрорушійна сила Е такого гальванічного елемента визначається різницею потенціалів вимірювального та порівняльного електродів:
Е = Для забезпечення однозначного зв'язку між ЕРС гальванічної елемента і концентрацією контрольованого іона вимірювальний електрод має бути селективним саме до цього іона і не реагувати на зміну концентрацій інших іонів, які містяться в аналізованій рідині.
а) б) Рис. 1. Схема гальванічного перетворювача потенціометричного аналізатора типу т.Н.02 а) та залежність його ЕРС від рН і температури б).
У практиці аналітичного контролю технологічних процесів в харчовій промисловості широкого застосування набули іоноселективні електроди, характерною ознакою яких є те, що в електродних реакціях не беруть участі електрони, а основною є реакція обміну іонами між розчинами, розділеними мембраною, яка має селективну проникність для одного типу іонів. Найбільшого поширення потенціометричні методи набули для вимірювання активної концентрації іонів водню у водних розчинах, яка характеризує їх кислі, нейтральні чи лужні властивості. Так як молекула води є досить сталою хімічною сполукою, то концентрація іонів водню і гідроксилу, порівняно з концентрацією її недисоційованих молекул, складає для одних і других, які рівні між собою при температурі 22 0С, величину: [Н+] = [ОН-] = 10-7 мг*іон/см3. (4) У відповідності із законом діючих мас добуток концентрації іонів водню та гідроксилу при даній температурі є величиною постійною і визначається константою Кв дисоціації води: Кв = К [Н2О]= [Н+]∙[ОН-] =10-14. (5) Якщо розчинити в нейтральному розчині іншу речовину і температуру розчину підтримувати незмінною, то величина 10-14 залишається постійною, але порушується рівновага і в розчині збільшується або кількість дисоційованих катіонів водню [Н+] за рахунок зменшення аніонів гідроксилу [OH-], або навпаки, зростає кількість аніонів гідроксилу за рахунок зменшення катіонів водню. В першому випадку, коли [Н+] > 10-7, розчин набуває кислотні властивості. В іншому випадку, коли [Н+] < 10-7, розчин має лужні властивості. Для зручнішого визначення концентрації іонів водню датський хімік Зеренсен ввів поняття водневого показника рН (р-Potenz – степінь, Н – хімічний символ водню). У відповідності з визначенням Зеренсена водневий показник рН – це десятковий логарифм концентрації іонів водню, взятий з від’ємним знаком: рН = -lg [Н+]. (9.5) Таким чином, концентрацією іонів водню [Н+] можна охарактеризувати будь-який розчин, причому для нейтрального середовища рН дорівнює 7, для лужного – рН>7, а кислого - рН<7. Дуже кислі розчини можуть мати рН= -1,-2, а концентровані луги рН>14. Вода, якій властиві в рівній мірі і кислотні і лужні властивості, є нейтральною тільки при температурі 22 0С. При підвищенні температури до 1000С вода набуває кислі властивості і її рН знижується до 6,12. За нульової температури вода набуває лужні властивості з рН=7,97. Для водних розчинів діапазон зміни рН складає 0…14. Первинні вимірювальні перетворювачі рН-метрів (гальванічні елементи) можуть бути утворені двома водневими півелементами, один з яких (вимірювальний електрод) занурюють у досліджуваний розчин, а другий (електрод порівняння) - в електроліт з нормальною активністю водневих іонів, з'єднуючи обидва півелементи за допомогою електролітичного ключа. Електрорушійна сила Е такого перетворювача за температури 18 °С:
де Однак унаслідок незручностей застосування, пов'язаних з необхідністю безперервно подавати до електродів газоподібний водень, водневий електрод використовують тільки в лабораторних умовах, найчастіше - як зразковий. В якості вимірювальних електродів найчастіше використовуються селективні електроди, які виготовлені із скла, або сурми. В якості допоміжних електродів використовуються хлорсрібні та каломельні. Разом вони утворюють гальванічну вимірювальну комірку. В якості вимірювального електроду у гальванічних перетворювачах рН-метрів зазвичай використовують скляний електрод із спеціальною селективною мембраною, яка має властивості водневого електрода і рН-функцію. Виникнення потенціалу пояснюється переходом іонів металу в розчин, а в стані рівноваги – переходом іонів металу в розчин і із розчину в електрод. Вимірювальний електрод (рис.1,а) виготовляють із каліброваної скляної товстостінної трубки 2, до одного кінця якої приварюється селективна мембрана 1 із спеціального тонкого (0,1мм) електродного гігроскопічного скла, в яке додають одновалентні метали К, Na, Li. Мембрана і є активною частиною електроду з рН-функцією за рахунок здатності до гідратації. Приблизний склад скла мембрани: 22% Na 2 O, 6% CaO та 72% SiO 2. Мембрани виготовляються різної форми (в вигляді кульки, списовидні, плоскі – у вигляді голки) в залежності від призначення електроду. В каліброваній частині скляної трубки розміщується 0,1 н. розчину 3 соляної кислоти HCl з невеликої кількості кристалів хлориду срібла. Ця частина скляного електроду складає півелемент порівняння, що розміщений в розчині з відомою постійною активністю катіонів, слугує для передачі значення потенціалу до вторинного приладу і він нечутливий до іонів водню контрольованого розчину. В цей розчин занурюється контактний хлорсрібний електрод 4, від якого відходить провідник 7 до вимірювального приладу ВП. Електрод герметизують герметиком 5 з ковпачком 6. Фактично чутливою до зміни рН розчину є мембрана (скло кульки, рис.1,а). Але для того, щоб вона функціонувала як рН-електрод, вона повинна бути гідратована. Для цього сухий скляний електрод необхідно витримати у воді протягом декількох годин. Гідратація скляної мембрани супроводжується обмінною реакцією між катіонами натрію скла і катіонами водню води. Гідратовані шари зовнішньої та внутрішньої поверхонь кульки складаються майже виключно з гелю кремнієвої кислоти і досягають товщини 10-5 - 10-4 мм. На внутрішній стороні кульки всі пустоти гелю зайняті катіонами водню.
Під час занурення гідратованого електроду вимірювальної комірки у контрольований розчин на межі скляної мембрани - розчин виникає скачок потенціалу, залежність величини якого від активності іонів водню задовольняє рівняння Нернста:
де ан - активність іонів водню розчину. Вимірювальний електрод (рис.1,а) в свою чергу має в своєму складі півелемент порівняння перший (електрод 4), розміщенийврозчин соляної кислоти з відомою сталою активністю катіонів водню і який призначений для створення першого виводу гальванічного елемента, та скляну мембрану, яка відділила кислотний розчин від контрольованого. Між поверхнями скляної мембрани і розчинами відбувається обмін катіонами. Активність катіонів Н+ в контрольованому розчині відрізняється від активності катіонів Н+ у кислоті в середині мембрани, остання є постійною. Так у шарі сухого скла переміщуються катіони Na+, а в шарах гідратованого скла переміщуються катіони і Н+ і Na+. Все це призводить до того, що на кожній із поверхонь розділу гелю і розчину відбувається перенесення катіонів: від гелю до розчину і навпаки. В наслідок цього виникають відповідні потенціали (рис. 1,а): ЕВН – на поверхні розділу гель – розчин соляної кислоти в середині кульки, та ЕХ - на поверхні розділу зовнішній шар гелю на кульці – контрольований розчин, який змінюється зі зміною рН цього розчину. Як допоміжні (порівняльні) електроди використовуються каломельні, хлорсрібні та бромсрібні електроди (півелементи). В харчовій промисловості переважно використовування хлорсрібні, які являють собою стержень 8 з срібла на поверхню якого наноситься шар малорозчинної солі AgCl (рис.1,а). Його розміщують у скляну трубку 2 в насичений розчин (КCl) хлористого калію, який через напівпроникну гумову мембрану 9 контактує з вимірювальним розчином. Допоміжний електрод (елемент порівняння другий) забезпечує замикання електричного ланцюга і слугує другим виводом гальванічного елемента вимірювальної рН-комірки. Таким чином, загальна ЕРС Е гальванічного елементу, що складається із вимірювального та допоміжного електродів, при його зануренні в контрольований розчин являє собою алгебраїчну суму наступних потенціалів, що виникають на окремих поверхнях розділу фаз: потенціалу контактного - ЕК між електродом 4 порівняння першим і розчином соляної кислоти, що знаходяться в середині кульки,; ЕВН – між розчином соляної кислоти та внутрішньою поверхнею мембрани; ЕХ – між зовнішньою поверхнею мембрани та контрольованим розчином; ЕД – між контрольованим розчином та допоміжним електродом (порівняння другий). Е = ЕК + ЕВН + ЕХ +ЕД. Так як значення ЕК, ЕВН та ЕД – величини практично сталі, то вимірювана Е змінюєтьсятільки зі зміною ЕХ і є рН-функцією контрольованого розчину. Якщо підставити в рівнянні Нернста значення констант при t0= 200С і прийняти Е0 =0, то потенціал електроду Ex дорівнює:
і має назву водневої функції, якапоказує, що у разі зміни рН розчину на одиницю, потенціал електроду змінюється на 58 мВ.
Широке поширення скляних іоноселективних електродів пояснюється їх суттєвими конструктивними та експлуатаційними перевагами перед іншими електродами. На скляні електроди не впливає наявність у розчинах окиснювальних чи відновних речовин, які неприпустимі для інших електродів. Скляні електроди мають стабільні характеристики, потенціали яких зв’язані з показником рН лінійною залежністю, та малу інерційність. Скляні електроди можуть працювати при температурах до 1000С, виготовляються різноманітні скляні електроди для використовування в різних середовищах в занурених і проточних перетворювачах, спеціально для використовування в харчовій промисловості (аналізу молока, кисломолочних продуктів, рослинних олій, тіста). Крім електродів зі скляними мембранами, у практику аналітичного контролю почали широко впроваджувати іоноселективні електроди з твердими та рідкими мембранами. Сурм’яні вимірювальні електроди виготовляються із металевої сурми в вигляді стержня, або платинового проводу, на який наносять шар сурми. Електродний потенціал виникає на межі металевої сурми і її окису, який утворюється на поверхні металу. Випускаються спеціальні електроди, які самоочищаються і використовуються для контролю кислотності тіста і інших дуже в’язких харчових продуктів. Промисловість випускає датчики зануреного типу ДПг-4м та проточного типу ДМ-5м, перетворювачі П201 і П210; вимірювачі рН-типу рН-201, 205, 261, 265 діапазон вимірювання 1-15 рН клас точності – 1.0;1,5 Для контролю кислотності молока – і молочних продуктів використовуються аналізатори типу рН – 222. Як вимірювальні використовуються скляні електроди типів ЕСА-45-07 і ЕСА-45-08, які розраховані для вимірювання рН розчинів в діапазоні (3÷8рН) в діапазоні температур від 0 до 400С. Похибка перетворювача ±0,05 рН. Останнім часом використовуються твердо контактні металізовані скляні електроди, в яких відсутня кислота. Як допоміжні найчастіше використовують хлорсрібні. Гальванічний перетворювач, який складається з водневого чи еквівалентного йому скляного електрода (півелемента) та допоміжного хлорсрібного (гальванічний перетворювач т.Н.02), за температури 18 °С розвиває ЕРС Вибір системи електродів для первинного перетворювача рН-метра, їх конструктивне оформлення і технічні характеристики визначаються умовами експлуатації, діапазоном вимірювання, потрібною точністю. Для промислових рН-метрів електродна система забезпечується додатковою захисною арматурою для захисту від механічних впливів та її закріплення на досліджуваному об'єкті (для застосування в апаратах виробляються ПВП рН-метрів заглибного виконання, а на трубопроводах - магістрального). Основними складовими похибки первинних перетворювачів рН-метрів є лужна, дифузійна та температурна похибки. Лужна похибка виникає в лужних середовищах у зв'язку з процесами іонного обміну лужних елементів, тобто переходу лужних іонів (натрію чи літію) із мембранного скла скляного електрода в досліджуваний розчин. Лужна похибка знижує значення вимірюваного рН і функціонально залежить як від значення рН, так і від концентрації лужних іонів натрію чи літію. Один з основних способів зменшення лужної похибки – розроблення спеціального мембранного скла. Слід відзначити, що лужна похибка різко зменшується з підвищенням температури. Під час вимірювання рН проточних розчинів у результаті утворення дифузійного потенціалу, що формується на діафрагмі електрода порівняння, виникає дифузійна похибка. У разі використання в електроді порівняння концентрованих розчинів електролітів з приблизно однаковою рухливістю аніонів і катіонів для дослідження розведених розчинів, концентрація яких менша за 0,1 моль/л, дифузійний потенціал не перевищує ±(0,2,..0,3) мВ. Для сильноконцентрованих розчинів дифузійний потенціал може досягати 10 мВ за корисної ЕРС гальванічного перетворювача в сотні мілівольтів. Для зменшення дифузійних потенціалів допоміжний електрод сполучають із досліджуваним розчином за допомогою електролітичного ключа, заповненого насиченим розчином КС1, на межах з яким дифузійні потенціали не перевищують 1...2 мВ. Найбільша складова похибки електродної системи рН-метра - температурна похибка, зумовлена залежністю електродних потенціалів вимірювального електрода за незмінного значення рН від температури. Результуючу ЕРС
Де Під час дослідження розчинів з високим рН температурна похибка може досягати до 10 %, тому в засобах вимірювань рН необхідно передбачити компенсацію цієї похибки. Та перш ніж перейти до вимірювальних кіл рН-метрів, слід відзначити одну особливість температурної залежності ЕРС: для конкретного гальванічного перетворювача за певного значення статичній характеристиці перетворення (рис.1,б), в так званій ізопотенціальній точці, температурна похибка відсутня, тобто:
звідки
Графіки залежності ЕРС гальванічного перетворювача т.Н.02 від рН для різних значень температури у вигляді сім'ї ізотерм, що перетинаються в одній ізопотенціальній точці А, показано на рис. 1,б. Координати ізопотенціальної точки електродів і її зазвичай визначаються експериментально. Для гальванічного перетворювача т.Н.02: Під час створення рН-метрів потрібно враховувати температурну залежність електродних потенціалів (у разі незмінного рН) і передбачати температурну компенсацію. Як видно з виразу (10), для Якщо ж урахувати вигляд залежностей
а з урахуванням температурної залежності:
Як випливає з виразу (13), температурну компенсацію в невеликому інтервалі змінювання температур можна зробити за допомогою одного терморезистора. Основна особливість рН-комірки ПВП, що електродні системи із скляними електродами мають надзвичайно високий внутрішній опір (до 1000 МОм), і вхідний опір приладу, який вимірює ЕРС ПВП рН-метра, повинен мати значно більший (не менше 1012 Ом) опір. Не виконання цієї умови приводить до поляризації електродів при їх під'єднанні до приладів і виникненню великих похибок вимірювання. Цим вимогам відповідають спеціальні високоомні прилади з підсилювачами постійного струму. При цьому вхідний опір приладу повинен бути в 1000 разів більший опору електродної комірки, що забезпечує відсутність ефекту поляризації. По принципу дії рН-метри ділять на три групи: прилади з безпосереднім відліком (рис.2,в) та прилади з астатичною (рис.2,а) і статичною (рис.2,б) компенсацією. Простіша схема безпосередньої оцінки (рис.2,в) складається із підсилювача 3 постійного струму, побудованого по балансній схемі (диференціальний підсилювач на польових транзисторах), який охоплений від'ємним зворотним зв'язком. Вимірювана ЕРС EХ підсилюється в 3 та надходить на прилад відліку 4. Прилади прості за будовою, але суттєво поступаються по класу точності приладам зі статичною та астатичною компенсацією. Найчастіше використовуються компенсаційні методи, оскільки в момент повної компенсації, коли різниця між ЕРС рН-метра і напругою компенсації дорівнює нулю, в ланцюгу відсутній струм, що еквівалентне режиму холостого ходу і значенням опору в ланцюгу, який сягає безмежності. Розрізняють статичні та астатичні схеми компенсації. .
∆U= Ex- Uк а) б) в) Рис.2. Схеми вимірювання ЕРС рН-метрів.
В більшості приладів використовується компенсаційний принцип з використовуванням мостових схем (рис. 2,а), які забезпечують простоту в налаштуванні, регулюванні і введенні температурних поправок. Нульовий індикатор-підсилювач Ні фіксує різницю ∆U між ЕРС EХ гальванічної комірки ПВП і напругою у вимірювальній діагоналі UCD мостової схеми, яка є напругою компенсації Ukm. При відхиленні ∆U від нуля в більшу або меншу сторону, нульовий індикатор-підсилювач випрацьовує відповідну сталу за амплітудою напругу змінного струму відповідної фази (0 або 180) для керування серводвигуном RD постійної швидкості обертання, який за кінематичною схемою переміщує повзунок реохорда (точку D вимірювальної діагоналі) в необхідному напрямку для зменшення відхилення ∆U до нуля, а також переміщує показник на шкалі приладу. Така астатична схема компенсації подібна схемі автоматичного потенціометра, який використовується для вимірювання температури в комплекті із термопарою. Принципова відмінність рН-метрів за такою схемою є наявність високоомного електронного підсилювача вимірювальної та компенсаційної схеми. Основний недолік схеми – наявність кінематичної схеми (на рисунку не показана) та повзунка реохорда, які є чинниками виникнення додаткових похибок. Більш надійними є схеми (рис. 2,б) із статичною компенсацією, які використовують підсилювачі з глибоким від’ємним зворотнім зв’язком по струму. ЕРС EХ порівнюється напругою UК компенсації, яка дорівнює UВИХ підсилювача і визначається спадом напруги на опорі R, через який протікає вихідний струм підсилювача ІВИХ. Напруга UВХ на вході підсилювача дорівнює різниці: UВХ = ∆U = EХ – UВИХ = EХ – UК = EХ - ІВИХ * R. (14) Якщо коефіцієнт підсилення підсилююча прийняти рівним К, а він в свою чергу дорівнює відношенню напруг на його виході та вході: К= UВИХ /UВХ то вираз (14) можемо перетворити до виду: EХ = (1 +1/К)UВИХ. (15) Із (15) видно, що при достатньо великому коефіцієнті підсилення К: EХ Таким чином, струм, який протікає у вихідному каскаді підсилювача (при сталому R) пропорційний ЕРС гальванічної комірки рН-метра. Вимірюючи струм ІВИХ міліамперметром, можна визначити EХ, тобто, рН розчину.
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 612; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.11.132 (0.014 с.) |

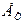 на металевому електроді, зануреному в розчин, що містить іони того ж металу, з якого виготовлено електрод, описується рівнянням Нернста, отриманим для розведених розчинів у припущенні, що поводження іонів у них підкоряється законам для ідеальних газів:
на металевому електроді, зануреному в розчин, що містить іони того ж металу, з якого виготовлено електрод, описується рівнянням Нернста, отриманим для розведених розчинів у припущенні, що поводження іонів у них підкоряється законам для ідеальних газів:
 (1)
(1) - нормальний (стандартний) потенціал електрода, що виникає в разі занурення його в розчин власних іонів з концентрацією 1 г-іон на 1 л; R - універсальна газова стала R = 8,31 Дж/моль*К; Т— абсолютна температура, К; п - валентність металу; F - стала Фарадея (постійна, яка визначає заряд грам-еквівалента-іонів) F=96485;
- нормальний (стандартний) потенціал електрода, що виникає в разі занурення його в розчин власних іонів з концентрацією 1 г-іон на 1 л; R - універсальна газова стала R = 8,31 Дж/моль*К; Т— абсолютна температура, К; п - валентність металу; F - стала Фарадея (постійна, яка визначає заряд грам-еквівалента-іонів) F=96485;  - концентрація іонів металу в розчині (у грам-іонах на 1 л).
- концентрація іонів металу в розчині (у грам-іонах на 1 л). , яка відображає той факт, що зі збільшенням концентрації іонів у розчині внаслідок їх взаємного впливу в утворенні електродного потенціалу бере участь лише частина з них. Тоді рівняння можна
, яка відображає той факт, що зі збільшенням концентрації іонів у розчині внаслідок їх взаємного впливу в утворенні електродного потенціалу бере участь лише частина з них. Тоді рівняння можна . (2)
. (2) (3)
(3) - коефіцієнт активності.
- коефіцієнт активності. дозволяє одержати інформацію про концентрацію контрольованих іонів в аналізованій рідині чи про її окислювально - відновні властивості.
дозволяє одержати інформацію про концентрацію контрольованих іонів в аналізованій рідині чи про її окислювально - відновні властивості. залишається постійним, оскільки він не залежить від концентрації іонів в аналізованій рідині.
залишається постійним, оскільки він не залежить від концентрації іонів в аналізованій рідині. .
.

 (6)
(6)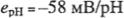 - питома ЕРС водневого перетворювача.
- питома ЕРС водневого перетворювача. , (7)
, (7) (8)
(8) = 54 мВ/рН.
= 54 мВ/рН. гальванічного перетворювача за зміни температури можна записати у вигляді:
гальванічного перетворювача за зміни температури можна записати у вигляді: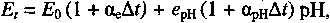 (9)
(9) - температурні коефіцієнти відповідних електродних потенціалів;
- температурні коефіцієнти відповідних електродних потенціалів;  - відхилення температури від номінального значення.
- відхилення температури від номінального значення. на його
на його (10)
(10) (11)
(11) залежать від характеру
залежать від характеру = -203 мВ,
= -203 мВ, 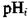 = 4,13 од.
= 4,13 од. така компенсація (коригування) можлива за допомогою двох терморезисторів, так як необхідно усунути адитивну складову зміни
така компенсація (коригування) можлива за допомогою двох терморезисторів, так як необхідно усунути адитивну складову зміни  за різних значень температури (рис. 1,б) і брати за початок координат точку перетину ізотерм, то функція перетворення електродної системи набуде вигляду
за різних значень температури (рис. 1,б) і брати за початок координат точку перетину ізотерм, то функція перетворення електродної системи набуде вигляду (12)
(12) (13)
(13)


 UВИХ = ІВИХ * R. (16)
UВИХ = ІВИХ * R. (16)


