
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Отличия анализа органических препаратовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Высокие молекулярные массы и сложное строение. 2. Термолабильность. 3. Способность гореть и обугливаться при прокаливании. 4. Неэлектролиты – неприменимы ионные реакции. 5. Реакции идут медленно, постадийно и могут быть остановлены на промеж. стадиях. 6. Иные Ткип, Тпл, наличие удельного вращения у ОАВ. 7. Большая применимость физических и физико-химических методов анализа. 8. Минерализация для подтверждения элементарной структуры и подлинности. 9. Функциональный и элементный анализ при определение подлинности, доброкачественности и количественном определении. Методы, используемые для определения подлинности, структуры и количественного определения. I. Химические II. Физико–химические. 1. Абсорбционные методы – основаны на измерении поглощения излучения: ИК, УФ, видимая – спектроскопия. 2. Исследование магнитного поля - спектроскопия ЯМР, ПМР, масс – спектроскопия. 3. Хроматография - бумажная, ТСХ, ГЖХ, ВЖХ, ГХ. 4. Поглощение рентгеновского излучения (рентгено-структурный) – изучение новых ЛП - дифракционный анализ. Связь между структурой и фармакологическим действием 1. Ненасыщенные соединения более активны, чем насыщенные. 2. Алифатические влияют на нервные окончания, ароматические – на двигательные. 3. Введение галогенов и их расположение обуславливают токсичность препарата и направленность его фармакологического эффекта. 4. Введение гидроксильной группы увеличивает всасываемость, растворимость. 5. Введение карбоксильной группы уменьшает токсичность. 6. Азотсодержащие молекулы увеличивают влияние препарата на различные отделы ЦНС (III – раздражает нервные центры и гладкую мускулатуру, IV – ганглиоблокаторы). 7. На активность препарата также оказывают влияние кристаллическая структура, растворимость, пространственная структура: цис- и транс- изомеры, оптическая активность (D- и L-изомерия), направление вращения (d- и l-изомерия). Препараты галогенпроизводных углеводородов Производные предельных и непредельных УВ, в молекуле которых один или несколько атомов замещены на галоген. Наличие галогена определяет химические свойства вещества. Вещества различны по агрегатному состоянию. Введение галогена сообщает препарату наркотические свойства (от F к I уменьшающиеся), противомикробную, противопаразитическую активность. Br – седативное действие, алифатические йодпроизводные – противомикробное действие, ароматические – рентгеноконтрастные. Связь углерод-галоген – ковалентная, при этом полярность и легкость разрыва ум. от F к I; это связано с ЭО (ум. от F к I), размерами атома (C-F-короткая, С-J – длинная рвется легче). Методы минерализации Для серосодержащих препаратов 1. Восстановительный (метод Файгля) - спекание с твердым HCOONa (формиат натрия). S ® Na2S + H+® H2S (запах). Na2S + Pb2+ ® PbS + 2Na+ (черный осадок) 2. Окислительный: Нагревание со смесью концентрированных азотной и соляной кислот. Иногда с одной из них. Это метод «мокрой» минерализации. “S” + конц. HNO3, HCl ® SO42- Ba2+ + SO42- ® BaSO4 Для азотсодержащих препаратов 1. Спекание с K2CO3, Na2CO3 или их смесью (безводные): “N” ® CN- 2. Спекание с безводным Na2S2O3 и K2CO3: “N” Для галогенсодержащих препаратов Предварительная проба Бельштейна: При нагревании галогенсодержащих препаратов в сухом виде на медной проволоке пламя окрашивается: для хлора – в желтый, для брома и йода – в синевато-зеленый цвет, т.к. при увеличении температуры образуются летучие галогениды меди. Не обнаруживается F-, т.к. его галогенид нелетуч. Пробой Бельштейна можно обнаружить как ковалентные галогены, так и галогены ионного типа. Неорганические галогениды не дают пробы Бельштейна. Выбор способа отщепления ковалентно связанного галогена зависит от природы галогена и структуры органической молекулы. Для мышьяксодержащих препаратов Спекание с K2CO3 и KNO3 (или Na 2 CO3 и NaNO3) в различных соотношениях. “As” Далее с магнезиальной смесью дает белый осадок: AsO43- + Mg2+ + NH4+ ® MgNH4AsO4 Для фосфорсодержащих препаратов Мокрая минерализация: “P”
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 523; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.008 с.) |

 [Fe(CN)6]4-
[Fe(CN)6]4-  Fe[Fe(CN)6] - – берлинская лазурь.
Fe[Fe(CN)6] - – берлинская лазурь.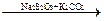 SCN-
SCN-  Fe(SCN)3 красного цвета.
Fe(SCN)3 красного цвета. AsO43-
AsO43- PO43-
PO43-  MgNH4PO4 (белый)
MgNH4PO4 (белый)


