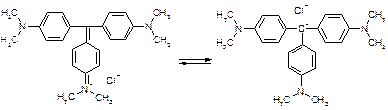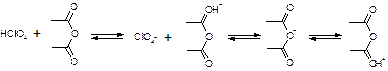Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Препараты алифатических спиртовСодержание книги
Поиск на нашем сайте
Наркотический эффект, активность, токсичность зависят от Мr, от их агрегатного состояния, растворимости, от количества гидроксильных групп, от их положения, от наличия других функциональных групп. Химическиесвойства. 1.Спирты – очень слабые кислоты, образуют алкоголяты с щелочными Ме. 2.Вступают в реакции этерификации с образованием сложных эфиров. 3.Окисляются до альдегидов, кислот и кетонов. Spiritus aethylicus. Спирт этиловый: 95%, 90%, 70% и 40% Получение: 1. Из крахмала: 2(C6H10O5)n + nH2O à nC12H22O11 – мальтоза C12H22O11 + H2O à 2C6H12O6 – глюкоза С6H12O6 à 2C2H5OH + CO2 2. Гидратацией этилена CH2=CH2 + H2SO4 à C2H5OSO3H Описание: прозрачная бесцветная летучая жидкость с характерным запахом и жгучим вкусом. Легко воспламеняется и горит синеватым бездымным пламенем Растворимость: во всех соотношениях с водой, эфиром, хлороформом, ацетоном, глицерином. Подлинность: 1. Реакция образования сложного эфира: C2H5OH + CH3COOH 2. Йодоформная проба. 2NaOH + I2 à NaIO + NaI + H2O С2H5OH + NaIO à CH3CHO + NaI + H2O CH3CHO + 3NaIO à CI3CHO + 3NaOH CI3CHO + NaOH à CHI3 (желтый крист.) +HCOONa 3. 3C2H5OH + K2Cr2O7 (желтый) + 4H2SO4 à 3CH3CHO (ябл) + Cr2(SO4)3 син-зел + K2SO4 + 7H2O Примеси: 1. Определение примеси метанола: 5CH3OH + 2KMnO4 + 3H3PO4 à 5HCHO + K2HPO4 + 2MnHPO4 + 8H2O
Количественноеопределение: По плотности спирта, по температуре кипения водно-спиртовой смеси. Применение: наружно в качестве антисептического и раздражающего средства для обтираний, компрессов. Растворитель для настоек, экстрактов.
Glycerinum. Глицерин. HOCH2-CH(OH)-CH2OH. Описание: Прозрачная, бесцветная, сиропообразная жидкость без запаха сладкого вкуса, рН нейтральная. Растворимость: Хорошо растворим в воде, спирте, практически не растворим в эфире и жирных маслах. Получение: 1. Гидролизом сложных эфиров глицерина 2. CH2=CH-CH3 Подлинность: 1. Под действием серной кислоты выделяется неприятный запах акролеина. глицерин 2. Cu(OH)2 + 2глицерин à ярко-синий растворимый глицерат меди (II) Количественноеопределение: по избытку уксусного ангидрида или NaOH на омыление образовавшегося эфира. глицерин + 3 укс. ангидрид à уксусно-глицериновый эфир + 3 укс. к-ты Применение: смягчающее действие при наружном применении, основа для приготовления мазей, мыл и др Препараты простых эфиров 1. образование оксониевых солей с концентрированными минеральными кислотами: R-O-R + HCl à [R-O+-R]Cl- 2. расщепляются в жестких условиях: R-O-R + HI = R-I + ROH или R-O-R 3. окисляются с образованием перекисных соединений: R-O-R Титрование в неводных средах как метод количественного определения: Достоинства титрования в неводных средах: 1. Можно определять органические и неорганические вещества, смеси различных компонентов, которые при титровании в водной среде не дают четкой КТТ (очень слабые кислоты и основания). 2. Можно титровать соединения, которые нерастворимы в воде, разлагаются водой, образуют эмульсии. 3. Можно использовать для бесцветных растворов. 4. КТТ можно определят индикатором, потенциометрически, кондуктометрически. 5. Можно титровать смеси без разделения. 6. Повышается точность титрования. Меньше поверхностное натяжение, меньше размер капли, меньше погрешность. Недостатки: 1. Необходимо тщательно обезвоживать все растворы, титранты. Титрование органических оснований и их солей в неводных средах: Титрант: HClO4 Растворитель: CH3COOH ледяная. Индикатор: кристаллический фиолетовый. Гексаметилпарарозанилинил хлорид. Три-(п-диметиламинофенил) карбоний хлорид. В щелочной среде фиолетовый, в кислой – желтый.
1. Растворение титранта. Образуется положительно заряженный ион "лиония" – ацетоний = ацелоний. HClO4 + CH3COOH «ClO4- + CH3COOH2+ 2. Растворение слабого основания в неводном растворителе. Образуется отрицательно заряженный ион "лиат" – ацетат. R3N + CH3COOH «R3N+H + CH3COO- 3. Нейтрализация лиония и лиата. Суть процесса, единственная необратимая реакция. CH3COO- + CH3COOH2+ à 2CH3COOH 4. ClO 4 - + R3N+H à [R3N+H]ClO4- Часто при титровании в ледяной уксусной кислоте добавляют уксусный ангидрид:
Роль уксусного ангидрида: 1. Связывает воду 2. Усиливает основные свойства слабых оснований (в большей мере, чем уксусная кислота). Смотри кофеин. 3. Ацилирует амино-, гидразино-группы, защищяя их при титровании. Смотри изониазид. 4. Способен связывать галогенид-ионы при титровании солей оснований в неводных средах. Титрование солей: R3N•HA + CH3COOH «R3NH+ + CH3COO- + HA (R3N)2H2SO4 + CH3COOH «R3NH+ + CH3COO- + (R3NH+)HSO4- Для солей серной, фосфорной, азотной кислот никаких особенностей больше нет. Они титруются по первой ступени, фактор равен единице. А если мы имеем дело с солями галоген-водородных кислот, то возникают сложности. Выделяющаяся кислота может повлиять титрование. HHal «H+ + Hal- Cl- + CH3COOH «HCl + CH3COO- И получится, что титрование идет не количественно. Поэтому надо связать все анионы галогенидов. Используют уксусный ангидрид: R3N•HHal + (CH3CO)2O «R3NH+ + CH3COO- + CH3COCl
Препараты: Aether medicinalis. Эфир медицинский. C2H5-O-C2H5 Описание: бесцветная прозрачная подвижная летучая легковоспламеняющаяся жидкость со своеобразным запахом. Растворимость: растворим в воде, неограниченно в спирте, бензоле, эф. и ж. маслах Получение: C2H5OH + H2SO4 à C2H5OSO3H + H2O C2H5OSO3H + C2H5OH à C2H5-O-C2H5 + H2SO4 Подлинность: Ткип и плотность Примеси: Пероксиды C2H5-O-O-C2H5 + 2KI + H2O à I2 + C2H5-O-C2H5 + 2KOH Альдегиды (темно-бурый осадок). CH3CHO + 3KOH + K2HgI4 à комплекс ртути + CH3COOK + 4KI + 2H2O Применение: растворитель для настоек, экстрактов, в фармацевтическом анализе. Хранение: в хорошо укупоренной таре склянках оранжевого стекла без света вдали от огня. Закупоривают корковыми пробками с пергаментной подкладкой и заливают специальной цинк-желатиновой массой.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 405; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.166.207 (0.01 с.) |

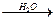 C2H5OH + H2SO4
C2H5OH + H2SO4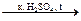 CH3COOC2H5 (запах) + H2O
CH3COOC2H5 (запах) + H2O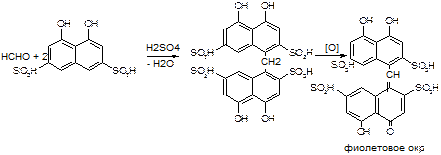 2. Определение примеси фурфурола:
2. Определение примеси фурфурола: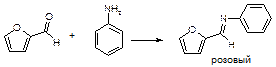
 CH2=CH-CH2Cl
CH2=CH-CH2Cl  Cl-CH2-CHOH-CH2OH
Cl-CH2-CHOH-CH2OH 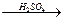 CH2=CH-CHO + 2H2O
CH2=CH-CHO + 2H2O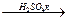 ROSO3H + ROH
ROSO3H + ROH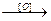 R-O-O-R
R-O-O-R