
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Bilignostum seu Adipiodon. Бис-(2,4,6-трийод -3-карбокси)анилид адипиновой к-тыСодержание книги
Поиск на нашем сайте
Описание: Белый мелкокристаллический порошок без запаха солоновато-горького вкуса. Растворимость: Практически нерастворим в воде, спирте, эфире и хлороформе. Легко растворим в диметилформамиде, в растворах едких щелочей и аммиака. Подлинность: 1) УФ спектр в 0,1М NaOH в области 230-300 нм должен иметь 1 мах – 236+-2нм 2) При нагревании с H2SO4 выделяются пары I2 фиолетового цвета. Количественное определение: ГФХ – косвенная йодометрия после минерализации. RI + KMnO4 + H2SO4к 2KMnO4 + 3NaNO2 + 3H2SO4 à 5NaNO3 + K2SO4 + 2MnSO4 + 3H2O 2NaNO2 + H2N-CO-NH2 + H2SO4 à 2N2 + CO2 + H2O + Na2SO4 KIO3 + 5KI изб. + 3H2SO4 à 3I2 + 3K2SO4 + 3H2O I2 + 2Na2S2O3 f=1/36; По новой статье: 1) Аргентометрия по Фаянсу после расщепления цинком в щелочной среде. f(Б)=1/6; f(I)=1; 2) Обратная алкалиметрия. Препарат + избыток титров. раствора NaOH + Ind (метил. красный, метил. синий). Избыток NaOH оттитровывается HCl до перехода окраски из зеленой в серо-зеленую. Параллельно проводят контрольный опыт. fБ=1/2; Хранение: Список Б,в хорошо закупоренных банках оранжевого цвета, в защищенных от света местах. Применение: В виде водных растворов в качестве рентгеноконтрастных средств.
Bromisovalum. (CH3)2CH-CHBr-CO-NH-CO-NH2 Описание: Белый кристаллический порошок горьковатого вкуса со слабым запахом. Растворимость: Мало растворим в воде, хорошо в 95% спирте. Подлинность: (CH3)2CH-CHBr-CO-NH-CO-NH2 + 4NaOH (CH3)2CH-CHBr-CO-NH-CO-NH2 + кH2SO4 à (CH3)2CH-CHOH-COOH запах + (NH2)2C=O•H2SO4 Ph-SO2-N(Na)Cl + NaBr Количественноеопределение: по Фольгарду. Хранение: По списку Б Применение: успокаивающее и снотворное действие.
3,5 – диацетиламино – (2,4,6 – трийод) бензойная кислота Применение: рентгеноконтрастное средство Хранение: список Б, в защищенном от света месте
Препараты альдегидов и их производных. Карбонильная группа – плоская, сильно поляризованная (на кислороде "-"), высокая реакционоспособность. То наркотики, антисептики, токсические вещества. Дополнительное введение галогена увеличивает активность и токсичность. Введение гидроксильной группы уменьшает токсичность и увеличивает способность образования гидратных связей. Cl3C-CO-H + H2O à Cl3C-CH(OH)2 хлоралгидрат (мало токсичен). Химические свойства 1. ОВР Легко окисляются до кислот. Эффект реакций не зависят от природы альдегида, а зависят от природы окислителя а) с реактивом Толленса. – реакция серебряного зеркала. В кристально чистой пробирке образуется налет серебра. R-CHO + 2[Ag(NH3)2]NO3 + H2O Реактив готовят: К AgNO3 прибавляют концентрированный NH4OH до растворения осадка. При хранении может образовывать аред серебра (взрывчатый). б) с реактивом Фелинга Реактив – смесь равных объемов раствора Фелинга 1 (CuSO4 + следов. H2SO4 – прозрачная жидкость голубоватого цвета) и раствора Фелинга 2 (сеньетова соль – тартрат калия натрия в растворе щелочи). Собственно реактив Фелинга – прозрачная жидкость ярко-синего цвета, комплекс соли меди (нижеприведенная формула – по Ильиной Татьяне Юрьевне; Трусов же Сергей Николаевич представляет себе комплекс меди с калия натрия татртратом несколько иначе – по его мнению, медь связывается по спиртовым гидроксилам только лишь с одной молекулой винной кислоты).
При добавлении альдегида и кипячении на водяной бане, выпадает осадок красно-бурого цвета. Альдегид + комплекс Фелинга + KOH + 3NaOH 2CuOH à Cu2O + H2O Гидроксид меди 1 – желтоватого цвета, очень неустойчив и быстро разлагается до кирпично-красного оксида. Реактив Фелинга не реагирует с ароматическими альдегидами, кроме 2,4 дигидроксибензаля. в) с реактивом Несслера. RCHO + K2[HgI4] + 3KOH à Hg¯ + RCOOK + 4KI + 2H2O Реакция идет мгновенно с формальдегидом. Кетоны не реагируют. Реакция очень чувствительна, используется для обнаружения примеси альдегида в спиртах, эфирах и для к.о. альдегидов. г) реакция обесцвечивания раствора йода. RCHO + I2 + H2O Реакцию ведут в слабощелочной среде, используют для к.о. альдегида. д) тетразолиевая проба.
2. Реакции нуклеофильного присоединения. а) с реактивом Шиффа
В эту реакцию вступают почти все алифатические альдегиды (кроме хлоралгидрата), некоторые кетоны, ароматические альдегиды. При рН<1 эта реакция специфична для формальдегида. Используют для обнаружения примеси формальдегида и метанола после окисления его до формальдегида б) с азотсодержащими реактивами: R-CHO + NH3 à RCH=NH R-CHO + NH2OH R-CHO + NH2-NH2 R-CHO + Ph-NH-NH2 (фенил гидразин) R-CHO + (о,п–NO2)2Ph-NH-NH2 (2,4 динитрофенилгидразин) Применение: Для подлинности, т.к. выпадает кристаллические осадки с четкими температурами плавления. Для к.о. (гравиметрия или тритриметрия). в) Присоединение бисульфита натрия (сульфита натрия). RCHO + NaHSO3 «R-CH(OH)-SO3Na¯ При нагревании в кислой среде разрушаются с выделением NaCl, H2O, SO2 Использование: для очистки и разделения смеси альдегидов и метилкетонов. Для количественного определения: RCHO + Na2SO3 «R-CH(OH)-SO3Na¯ + NaOH (эквивалентное количество).
3. Реакции конденсации с фенольными соединениями. SE в ядро. а) р. Хичкока.
В результате реакции получается ауриновый краситель розово-красного цвета. В случае формальдегида возможно образование триспроизводных трифенилметанового ядра. Реактив Марки – это раствор формаля в концентрированной серной кислоте. б) р. Идрайве.
Хромотроповая кислота, она же 1,8-дигидроксинафталин, 3,6-дисульфокислота или ее динатриевая соль. Получается фиолетовое вещество, в случае формаля – пурпурное.
4. Реакция линейной и циклической полимеризации. Используются для получения гексаметилентетрамина и длительном хранении. nHCHO + H2O à HCH(OH)2 «(HO-CH2-O-CH2-O-)n, -(CH2-O-)n – параформ, белая кристаллическая масса. Физико-химический анализ по карбонильной группе затруднен, т.к. группа – слабый хромофор. ФХМА используются редко.
Методы к.о. 1. Окислительно-восстановительные (титриметрические). 2. Реакции конденсации (фотометрические методы), гравиметрические методы. Препараты: Solutio Formaldehydi (Formalinum). Формальдегид – водный раствор 37% Описание: бесцветная, прозрачная жидкость со своеобразным острым запахом, смешивается во всех соотношениях с водой и спиртом. В качестве стабилизатора содержит метанол до 1%, он также предотвращает реакцию полимеризации. Получение: 2CH3OH + O2 Подлинность: 1. Реакция серебрянного зеркала (см. химические свойства 1а). 2. C салициловой кислотой (см. химические свойства 3а). Чистота: допустима примесь HCOOH не > 0,2%, ее определяют, титруя щелочью (алкалиметрически) с индикатором ФФ. КО: 1) Обратная йодометрия в щелочной среде. Аликвота + избыток титрованного раствора I2 + щелочь. I2 в щелочной среде диспропорционирует с образованием NaIO, который окисляет HCHO до HCOONa. I2 + 2NaOH à NaIO + NaI + H2O побочно: 3NaIO à NaIO3 + 2NaI Ставим в темное место, подкисляя H2SO4 HCHO + NaIO + NaOH à HCOONa + NaI + H2O NaI + NaIO + H2SO4 à I2 + Na2SO4 + H2O Титруем 0,1М Na2S2O3 I2 + Na2S2O3 à 2NaI + Na2S4O6 f(HCHO) = ½ Параллельно ставим контрольный опыт.
Нефармакопейные: 1) С реактивом Несслера – обратная йодометрия по отношению к ртути, избыток йода оттитровываем Na2S2O3. С реактивом Несслера (K2HgI4) образуется свободная ртуть. Hg + I2 à HgI2¯ f= ½ 2) Бисульфитный метод. HCHO + Na2SO3 à HO-CH2-SO3Na•NaOH NaOH + HCl à NaCl + H2O Титруют раствором хлороводорода 0,1М. Индикатор – ФФ, до исчезновения розовой окраски. f=1 Параллельно контрольный опыт
3) Окисление перекиси – алкалиметрия в присутствии пергидроля. HCHO + H2O2 + NaOH(изб) Избыток NaOH оттитровываем HCl. Индикатор – ФФ или БТС f=1 Контрольный опыт 4) Гидроксиламиновый HCHO + NH2OH•HCl à H2C=N-OH + HCl HCl титруют NaOH. Индикатор БТС. f=1 Расчетная формула без контрольного опыта. 4) Рефрактометрия 5) Спектрофотометрия Применение: Антисептик, дезинфектант Хранение: в склянке оранжевого стекала при температуре не менее 9 С. Рецептура: Если раствор формальдегида, то исходят из фактической концентрации (37%). Если раствор формалина, то 37% раствор принимают за 100% и уже исходя из этого готовят разведение При вдыхании - отравление, слезоточивость, кашель. При употреблении внутрь – тошнота, понос. Chlorali hydras – 2,2,2трихлорэтандиол 1,1. Cl3C-CH(OH)2 Описание: бесцветные прозрачные кристаллы с характерным запахом, на воздухе улетучивается, гигроскопичен, легко растворим в воде, спирте, эфире и CHCl3 Подлинность: 1. Гидролиз щелочной при комнатной температуре. Растворяем в воде, добавляем щелочь, взбалтываем. Образуется мутная жидкость с характерным запахом хлороформа. Cl3C-CH(OH)2 + NaOH à CHCl3 + HCOONa + H2O 2. С реактивом Толленса. Образуется черный осадок серебра. Мгновенная реакция. Cl3C-CH(OH)2 + [Ag(NH3)2]NO3 à Ag¯ + Cl3-C-COOH + NH3 + NH4NO3
Нефармакопейные: 1. Реакция конденсации с фенольными соединениями в щелочной среде. Cl3C-CH(OH)2 + NaOH à CHCl3 + HCOONa + H2O CHCl3 + NaOH à CCl2 (дихлоркарбен) + NaCl + H2O
При нагревании с резорцином в щелочной среде. Аналогично - с фенолом и тимолом. Чистота: прозрачность и цветность, кислотность (МО должен быть желтым), органические примеси (обнаруживают по реакции с концентрированной H2SO4). Общедопустимые примеси: хлориды и тяжелые металлы. Специфические недопустимые: хлоральалкоголят (он же моноэтилацеталь хлоральгидрата). Не должно быть осадка и запаха йодоформа при нагревании с йодом в щелочной среде. Йодоформная проба (выпадает желтый кристаллический осадок с характерным запахом): Cl3C-CH(OH)-OC2H5 + NaOH C2H5OH + 4I2 + 6NaOH КО: Обратная Алкалиметрия. Cl3C-CH(OH)2 + NaOH изб à CHCl3 + HCOONa После добавления NaOH, ее избыток оттитровывают соляной кислотой. Индикатор ФФ – до исчезновения розовой окраски. f=1 Контрольный опыт. Нефармакопейные: Обратная йодометрия в щелочной среде или среде карбонатного буфера. Аликвота + избыток йода, оттитровывают Na2S2O3 f=1/2 (если окисляется до кислоты) Применение: мягкое успокаивающее, седативное и снотворное, в детской практике. В порошках и клизмах. Противосудорожное. Хранение: по списку Б, в хорошо упакованной таре в темном месте, на свету разлагается с образованием: 2CCl3CHO Glucosum Подлинность: с реактивом Феллинга. Не ГФ: 1) Конденсация с тимолом (с кH2SO4) à темно-красное окрашивание.
2) С резорцином (+HCl / H2SO4) à(t) розовое, красное окрашивание. 3) Получение озазона глюкозы с фенилгидразоном в кислой среде. Чистота: удельное вращение – правовращающая, в ФС допускается интервал (указ. концентрация раствора, растворитель). Прозрачность, цветность, кислотность, общедопустимые: хлориды, сульфаты, кальций Недопустимые: барий, декстран КО: не проводится. Для инъекций – рефрактометрия. Не ГФ: метод Вильштеттера. Обратная йодометрия. В щелочной или карбонатной среде. + избыток йода, окисляется до … к-ты., Йод оттитровываем Na2S2O3..Международный метод – Na2CO3 вместо щелочи Hexamethylentetraminum (CH2)6N4 – 1,3,5,7 тетраазотрицикло[3,3,1,13,7]-декан
Описание: белый кристаллический порошок без запаха, возгоняем, вкус жгуче сладкий, легко растворим в воде, спирте, растворим в хлороформе, мало растворим в эфире. Подлинность: По новой статье: ИК спектр По ГФ 10 1) Определяют по запаху (CH2)6N4 + H2SO4 + 6H2O à 6HCHO(запах) + 2(NH4)2SO4 2) по запаху аммиака и посинению красной лакмусовой бумажки (NH4)2SO4 + 2NaOH (30%) à 2NH3 + Na2SO4 НЕ ГФ 1. Обнаружение HCHO – реакция серебрянного зеркала, реакция с ауриновым красителем (розовое окрашивание) и с хромотроповой кислотой (фиолетовое окрашивание) 2. Реакция на третичный азот. С осадительными веществами: с фосфорно-вольфрамовой кислотой à бел, амфотерный осадок с фосфорно-молибденовой кислотой à желтый осадок с пикриновой кислотой à желтый осадок 3. С раствором йода дает полийодид, осадок бурого цвета. (CH2)6N4 + I2 можно использовать эту реакцию для к.о. 4. С бромом образует бледно-желтый осадок, растворимый в избытке реактива. 5. с AgNO3 в нейтральной среде: 2(CH2)6N4 + 3AgNO3 à 2(CH2)6N4•3AgNO3¯ белый осадок Чистота: прозрачность, цветность, щелочность, кислотность, рН, органические примеси, общие допустимые (хлориды, сульфаты), недопустимые примеси – соли аммония и параформ (с раствором Несслера не должно быть окрашивания и помутнения раствора). Для инъекций недопустимы амины (реакция с нитропруссидом натрия, или с Несслером в больших концентрациях).
Количественноеопределение: Обратная ацидиметрия. (CH2)6N4 + H2SO4(избыток титр. раствора) + 6H2O
избыток H2SO4 титруем NaOH с индикатором метиленовым Красным. f=1/4 % = T(NaOH/(CH2)6N4) * (Vконтр(NaOH) – Vопыт(NaOH)) * 100/ a Нельзя использовать серную кислоту, т.к. хлорид аммония возгоняется, нельзя использовать ФФ, чтобы не оттитровать (NH4)2SO4 Не ГФ. Прямая ацидиметрия (CH2)6N4 + HCl à (CH2)6N4•HCl = [(CH2)6N3NH+]Cl- Протон присоединяется по одной электронной паре. Индикатор – смесь МО и МС. Титруют от зеленой окраски до фиолетовой. f=1 2) Йодометрия (используется редко, т.к. необходим специальный титрованный раствор йода). В результате реакции с йодом образуются перйодиды, которые выпадают в осадок, которые отфильтровывают. Избыток йода титруют тиосульфатом. Если не отфильтровать осадка, он будет разрушаться тиосульфатом. Контрольный опыт. f=1/4 3) Обратная йодхлорметрия (CH2)6N4 ICl (изб. титров. раствора) à (CH2)6N4•2ICl¯ комплекс желтого цвета, устойчивый в нейтральной среде. избыток ICl + KI à I2 + KCl I2 + Na2S2O3 à NaI + Na2S4O6 f=1/4 4) Аргентометрия 2(CH2)6N4 + 3AgNO3 à 2(CH2)6N4•3AgNO3 белый осадок Определяют: гравиметрически, или титруя избыток нитрата серебра по методу Фаянса Хранение: в хорошо упакованной таре Применение: дезинфицирующее и антисептическое при заболеваниях почек и мочеполовых путей. Принимают внутрь и парентерально. Инъекционные растворы готовят в асептических условиях и не стерилизуют Camphora
Натуральная правовращающая d-camphora получается из камфорного дерева. Синтетическая левовращающая l-camphora из пихтовых. С 1985 г. ФС – испытание рацемической камфоры для инъекционных препаратов. Подлинность – не доказывается. По зарубежным ФС: 1. ИК-спектроскопия 2. УФ спектроскопия спиртового раствора 3. Температура плавления гидразина и оксима камфоры.
Продукты конденсации с фурфуролом:
С бензальдегидом дает красное окрашивание. Количественное определение: По ГФ НЕ ТРЕБУЕТСЯ! Хромотография (подлинность, количественное определение, чистота) КО (не ГФ): 1). Гидроксиламиновый (оксимовый). Камфора + NH2OH•HCl à Оксим камфоры¯ (вместо =O, =N-OH) + HCl Осадок определяют гравиметрически, или по HCl алкалиметрически (инд БТС, Э=М.м. f=1) 2). Фенилгидразиновый. Камфора + Ph-NH-NH2•HCl à Фенилгидразин камфоры¯ (вместо =O, =N-NH-Ph) + HCl Далее все также, как в методе 1. 3). Фотокалориметрия с бензальдегидом. Раствор для инъекций – весовой метод количественного определения. Точную навеску …, охлаждают, взвешивают, по уменьшению массы вычисляют количество камфоры. Применение: наружно – раздражающее Citralum Оптически неактивная смесь двух изомеров, запах лимона. В воде не растворим, смешивается со спиртом.
Подлинность: бисульфитное производное => двойная связь, обесцвечивание бромное воды, раствора марганцовки. Реакции, характерные для альдегидов. КО: 1). Оксимный метод. f=1 (см. раньше) 2). Йодхлорметрия f=1/2
3). Косвенная йодометрия – избыток йода. (контрольный опыт) Применение: антисептик в офтальмологии. Коррелирующее средство в детских микстурах, при гипертонии.
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 536; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.009 с.) |


 KIO3 + K2SO4 + MnSO4 + H20 + прод. окисления
KIO3 + K2SO4 + MnSO4 + H20 + прод. окисления 2NaI + Na2S4O6
2NaI + Na2S4O6


 (CH3)2CH-CHOH-COOH + NaCl
(CH3)2CH-CHOH-COOH + NaCl Ph-SO2NH2 + NaCl + Br2 (хлороформный слой окрашивается в буро-оранжевый цвет).
Ph-SO2NH2 + NaCl + Br2 (хлороформный слой окрашивается в буро-оранжевый цвет).
 Ag¯ + RCOONH4 + NH3 + NH4NO3
Ag¯ + RCOONH4 + NH3 + NH4NO3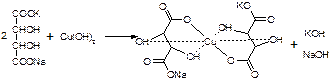
 RCOOH + 2HI
RCOOH + 2HI

 R-CH=N-OH (оксимы)
R-CH=N-OH (оксимы)

 HCHO + 2H2O
HCHO + 2H2O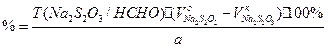
 H2HgI4
H2HgI4
 HCOONa + 2H2O
HCOONa + 2H2O
 Cl2CH-CHO + Cl3-C-COOH + HCl + H2O
Cl2CH-CHO + Cl3-C-COOH + HCl + H2O

 (CH2)6N4•I4•KI¯
(CH2)6N4•I4•KI¯ 6HCHO + 2(NH4)2SO4
6HCHO + 2(NH4)2SO4








