
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции на общие примеси (С. 166, Т. 1 гфxi)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Cl- Методика (из ГФ 11): к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 0,5 мл азотной кислоты, 0,5 мл раствора нитрата серебра, перемешивают и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору. NaCl + AgNO3 Выпадает белый творожистый осадок, белая муть или опалесценция, не исчезающая при добавлении HNO3, но исчезающая при добавлении NH4OH. AgCl¯ + 2NH4OH à [Ag(NH3)]Cl + 2H2O Среда кислая, т.к. в щелочной среде выпадает черный осадок: 2Ag+ + 2OH- à AgOH à Ag2O¯ Предел обнаружения – 0,1 мг Эталон – прокаленный NaCl, С = 2 мкг Cl- в 1 мл
SO42- Методика: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 0,5 мл разведенной хлористоводородной кислоты и 1 мл раствора хлорида бария, перемешивают и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору K2SO4 + BaCl2 Белый осадок или муть, не исчезающая при добавлении HCl разведенной. BaSO4 + H+ (минер. к-ты) ½ Испытываемый раствор должен иметь нейтральную среду: Ba2+ + 2OH- àBa(OH)2. Среда должна быть солянокислой, т.к. в ней растворимы другие соли бария. Эталон: K2SO4, высушенный при 100-150°С до постоянной массы. С = 0,01 мг/мл
NH4+ Первый способ (с реактивом Несслера): Методика: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 0,15 мл реактива Несслера, перемешивают и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактива, какое прибавлено к испытуемому раствору. Окраска, появившаяся в испытуемом растворе, не должна превышать эталон. NH4Cl + 2K[HgI4] à [I-Hg-NH2+-Hg-I]I-¯+ KCl + H2O Исследуемый препарат должен иметь нейтральную или слабощелочную среду, так как в сильнощелочной среде: NH4+ + OH-à NH3 Если исходная реакция среды кислая, то надо нейтрализовать, т.к. разрушится конечный комплекс. Мешают ионы некоторых металлов – осадки гидроокисей. Их надо осадить. Эталон: NH4Cl, высушенный в эксикаторе над H2SO4 до постоянной массы. Второй способ (безэталонный): Методика: 5 мл раствора испытуемого препарата, указанной в соответствующей частной статье концентрации, помещают в коническую колбу вместимостью 25 мл, прибавляют 5 мл раствора едкого натра. Сверху колбы помещают смоченную водой красную лакмусовую бумагу и закрывают часовым стеклом. Колбу ставят на водяную баню. Наблюдение проводят через 5 мин. NH4+ + NaOH Определяют по запаху или по посинению красной лакмусовой бумажки.
Ca2+ Методика: К 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 1 мл раствора хлорида аммония, 1 мл раствора аммиака и 1 мл раствора оксалата аммония, перемешивают и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору В среде аммиачного буфера: Ca2+ + (NH4)2C2O4 à(NH4OH, NH4Cl) CaC2O4¯ + 2NH4+ Выпадает белый мелкокристаллический осадок или белая муть, не исчезающая при прибавлении CH3COOH, но растворимая в HCl, HNO3. В присутствии HCl, HNO3 идет обратная реакция. Эталон: CaCO3, высушенный при 100-150°С до постоянной массы.
Fe3+/Fe2+ Методика: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 2 мл раствора сульфосалициловой кислоты и 1 мл раствора аммиака и через 5 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора В и такого же количества реактивов, какое прибавлено к испытуемому раствору.
Эталон: железоаммонийные квасцы FeNH4(SO4)•12H2O. Рабочий раствор В, а не Б. Сперва определяют содержание железа в железоаммонийных квасцах, титруя его тиосульфатом натрия. Исходя их концентрации установленной, готовят 0,1% раствор.
Zn2+ Методика: к 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 2 мл хлористоводородной кислоты, 5 капель раствора ферроцианида калия и через 10 мин сравнивают с эталоном, состоящим из 10 мл эталонного раствора Б и такого же количества реактивов, какое прибавлено к испытуемому раствору. Муть, появившаяся в испытуемом растворе, не должна превышать эталон. Zn2+ + K4[Fe(CN)6] Белая муть, нерастворимая в разведенных кислотах, но растворимая в щелочах. Кислая среда увеличивает специфичность и чувствительность реакции к цинку. В щелочной среде образуется Zn(OH)2 (pH=10), ZnO22- (pH=13) Если образуется синь, то препарат содержит большую примесь железа, значит его надо осадить в виде гидроокиси, отфильтровать. Эталон: ZnO прокаливают до постоянной массы, растворяют в NHO3.
Pb2+ Методика: К 10 мл раствора испытуемого препарата, приготовленного, как указано в соответствующей частной статье, прибавляют 1 мл разведенной уксусной кислоты, 2 капли раствора сульфида натрия, перемешивают и через 1 мин сравнивают с эталоном, состоящим из 1 мл эталонного раствора Б, такого же количества реактивов, какое прибавлено к испытуемому раствору, и 9 мл воды Pb2+ + S2- à PbS¯ (черный осадок) As Первый способ: (реакция Зингера-Блека)
Методика: В колбу, где находится соответс твующим образом приготовленное вещество (см. ниже), прибавляют от 10 до 12 капель раствора дихлорида олова, 2 г гранулированного цинка (без мышьяка) и тотчас закрывают колбу пробкой со вставленной в нее верхней частью прибора. Содержимое колбы осторожно взбалтывают и оставляют на 1 ч. При этом температура реакционной смеси не должна превышать 40 град. С. Параллельно в другом таком же приборе проводят контрольный опыт со всеми реактивами и с прибавлением 0,5 мл эталонного раствора мышьяка. Через 1 ч полоску бумаги, пропитанную раствором дихлорида ртути, помещают в раствор йодида калия. Через 10 мин раствор йодида калия сливают, полоску бумаги тщательно промывают несколько раз водой декантацией в том же стакане и сушат между листами фильтровальной бумаги. Полоска бумаги, взятая из прибора с исследуемым веществом, не должна быть окрашенной или окраска ее не должна быть интенсивнее окраски полоски бумаги в контрольном опыте. H3AsO3 + 3H2 à AsH3 + 3H2O AsH3 + HgCl2 àAsH2(HgCl) + HCl AsH3 + 2HgCl2 àAsH(HgCl)2 + 2HCl AsH3 + 3HgCl2 àAs(HgCl)3 + 3HCl As(HgCl)3 + AsH3 àAsHg3¯ арсид ртути HgCl2 + 2KI à HgI2 красно-бурый Эталон: As2O3 – точная навеска. 1 - колба; 2 - стеклянная трубка; 3 - тампон из ваты, пропитанной раствором ацетата свинца; 4 - стеклянная трубка;5 - бумага, пропитанная раствором дихлорида ртути. Второй способ: (реакция Буго-Тиле) В случае определения наряду с Se, Te, а также для определения As в присутствии Sb, Bi, Hg, Ag, SO32-, S2- Методика: Навеску вещества после предварительной обработки, описанной в соответствующей частной статье, вносят в пробирку, прибавляют 5 мл раствора гипофосфита натрия, помещают в пробирку в кипящую водяную баню и нагревают в течение 15 мин. В испытуемой жидкости не должно быть заметно ни побурения, ни образования бурого осадка. В случае полбурения или образования бурого осадка в пробирку после охлаждения прибавляют 3 мл воды, 5 мл эфира и тщательно взбалтывают. При наличии мышьяка на границе жидкостей образуется бурая пленка. NaH2PO4 + HCl 3H3PO2 + As2O3 à 2As + 3H3PO3 5H3PO2 + As2O3 à 2As + 5H3PO3
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 695; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.008 с.) |

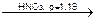 AgCl¯ + NaNO3
AgCl¯ + NaNO3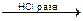 BaSO4¯ + 2KCl
BaSO4¯ + 2KCl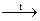 NH3 + H2O
NH3 + H2O
 ZnK2[Fe(CN)6]¯ + 2K+
ZnK2[Fe(CN)6]¯ + 2K+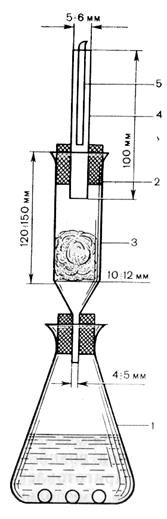 Соединения As под действием Zn и HCl (H2SO4) восстанавливаются в мышьяковистый водород (арсин), который соприкасается с бумагой, пропитанной HgCl2, окрашивая в оранжевый цвет, а после обработки KI в бурый цвет. Вата, пропитанная ацетатом свинца нужна для устранения примеси H2S.
Соединения As под действием Zn и HCl (H2SO4) восстанавливаются в мышьяковистый водород (арсин), который соприкасается с бумагой, пропитанной HgCl2, окрашивая в оранжевый цвет, а после обработки KI в бурый цвет. Вата, пропитанная ацетатом свинца нужна для устранения примеси H2S.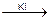 K2HgI4 бесцветный
K2HgI4 бесцветный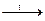 H3PO4 + NaCl
H3PO4 + NaCl


