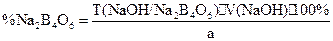Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Solutio Hydrogenii peroxydi dilutaСодержание книги
Поиск на нашем сайте Состав:Пергидроля – 10г, антифебрин – 0,5%, воды до 100 мл Описание:Бесцветная прозрачная жидкость без запаха Подлинность: к 1 мл препарата прибавляют 0,2 мл H2SO4 разведенной, 2 мл эфира, 0,2 мл раствора K2Cr2O7 и взбалтывают, эфирный слой окрашивается в синий цвет K2Cr2O7 + H2SO4 à H2Cr2O7 + K2SO4 H2Cr2O7 + 4H2O2 à H2Cr2O8 + H2O Количественное определение: 1. Безындикаторная перманганатометрия: 10мл раствора помещают в мерную колбу на 100 мл и доводят водой до метки, к 10 мл полученного раствора прибавляют 5мл H2SO4 разведенной и титруют 0,1М KMnO4 до устойчивой розовой окраски: 2KMnO4 + 5H2O2+3 H2SO4 à 2MnSO4 + K2SO4 + 8H2O + 5O2 f(H2O2) = ½; 2. Косвенная йодометрия: 2KI + H2O2 + H2SO4 р. à I2 + K2SO4 + 8H2O I2 + 2Na2S2O3 à 2NaI + Na2S4O6 f(H2O2) = ½; 3. Прямая цериметрия 4. Фотоколориметрия 5. Спектрофотоколориметрия 6. Рефрактометрия Вещества в препарате должно быть 2,7-3,3%. Хранение:в склянках темного стекла с притертой пробкой, в прохладном месте без доступа света. Применение: антисептическое, дезодорирующее, депигментирующее и кровоостанавливающее средство
Другие препараты перекиси водорода Perhydrolum – 30% H2O2. Hydroperitum – 33-35% H2O2, (NH2)2CO, лимонная кислота. Magnesii peroxydum –25%MgO2+75%MgO.
Cоединения бора. Acidum boricum – кислота борная – H3BO3 Получение: 1. Из минерала "амарита": B2O3•2MgO•H2O + 2H2SO4 à 2MgSO4 + 2H3BO3 2. Из буры (натрия тетрабората): Na2B4O7 + 2HCl + 5H2O à H3BO3 + 2NaCl Описание: бесцветные или белые блестящие жирные чешуйки; или белый мелкокристаллический порошок. Летуч с водяными порами и парами спирта. H3BO3 4HBO2 Растворимость: Р в воде, ЛР в кипящей воде, Р в спирте, МР в глицерине. Константа гидролиза = 6,4•10-10 – слабокислая среда. В водном растворе не диссоциирует, метиленовый оранжевый свой цвет не меняет. B(OH)3 + H2O «[B(OH)4]H «[B(OH)4]- + H+ В глицерине борная кислота образует более сильную глицероборную кислоту:
Эта кислота по силе как уксусная, рН=4. Подлинность: 1. Раствор кислоты в спирте с концентрированной серной кислотой горит пламенем, окаймленным в зеленый цвет. B(OH)3 + 3C2H5OH 2. На куркумовой бумаге светло-желтого цвета. На бумагу наносят 1 каплю H3BO3, 1 каплю HCl, высушивают, бумага окрашиваются в розовый цвет.
При обработке аммиаком, бумага окрашивается в фиолетовый или зеленовато-черный цвет:
Количественное определение: Прямая алкалиметрия в водно-глицериновом растворе. Точную навеску растворяют в воде, очищенной от углекислого газа. Прибавляют нейтрализованного по фенолфталеину глицерина (титруют щелочью до появления розовой окраски). Титруют NaOH до установления розовой окраски, в конце титрования прибавляют еще порцию глицерина, титруют; титруют и добавляют глицерин до тех пор, пока розовая окраска не перестанет исчезать (при добавлении новых порций глицерина метаборная кислота переходит в ортоборную). f=1; Хранение: в хорошо упакованной таре. Применение: в качестве наружного антисептика – мази, примочки, спиртовые растворы. Токсична, нарушает функции почек.
Natrii tetraborax – натрия тетраборат – Na2B4O7•10H2O
Получение: 4H3BO3 + Na2CO3 à Na2B4O7 + CO2 + 6H2O Описание: бесцветные прозрачные кристаллы или белый кристаллический порошок без запаха. Растворимость: Р в воде, ОЛР в кипящей воде, ЛР в глицерине, ПНР в спирте. рН>7 (гидролиз по аниону). Глицериновый раствор имеет кислую реакцию
Подлинность: реакции 1, 2 для борной кислоты (после подкисления) + реакции на натрий. Количественное определение: Прямая ацидиметрия в водном растворе. Индикатор – метиленовый оранжевый, титрант – 0,1M HCl. Na2B4O7 + 2HCl + 5H2O à 2NaCl + 4H3BO3 f= ½; Хранение: в хорошо упакованной таре. Применение: в качестве наружного антисептика - для полосканий, смазываний. Водные растворы, растворы в глицерине. Соединения кальция, магния, бария, цинка, висмута. Комплексонометрия Комплексонометрия – химический, титриметрический метод анализа, основанный на образовании устойчивых бесцветных комплексов металла с комплексонами (аминополикарбоновые кислоты и их соли).
Главный комплексон – динатриевая соль этилендиаминотетрауксусной кислоты (ЭДТА) – трилон Б. Его титр определяют по точной навеске MgSO4, CaCO3 или ZnSO4. Для определения точки эквивалентности используют индикаторы.
Индикаторы:
|
||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 634; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.007 с.) |



 HBO2
HBO2 H2B4O7 (тетраборат) à 2B2O3 (борный ангидрид, стекловидный плав)
H2B4O7 (тетраборат) à 2B2O3 (борный ангидрид, стекловидный плав)
 B(OC2H5)3 зеленая кайма + 3H2O
B(OC2H5)3 зеленая кайма + 3H2O