
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
По теме: «физико-химические свойства белков».Содержание книги
Поиск на нашем сайте
Исходный уровень знаний: · Стереохимия аминокислот. · Понятие о диффузии и диализе. · Что такое осмотическое и онкотическое давление. · От чего зависит подвижность веществ в электрическом поле. · Амфотерность.
Задания для работы. 1. Напишите формулами фрагмент пептида -Глу-Мет-Лиз- Тир-.
а) определите суммарный заряд пептида при рН 7,0, укажите, в какой среде лежит его изоэлектрическая точка;
б) допишите еще 2 аминокислоты, чтобы суммарный заряд пептида был: 1. отрицательный
2. нейтральный
3. положительный
в) на примере одного из написанных пептидов пунктиром покажите один виток α-спирали, назовите связь, стабилизирующую его и группы, которые ее образуют;
г) из написанных пептидов выберите пары аминокислот, способные образовывать связи между радикалами, укажите тип связи, назовите, какой структурный уровень они стабилизируют.
2. Назовите факторы устойчивости белков в растворе. Чем обусловлен заряд белков в растворе? Почему растворимые белки могут быть названы полиэлектролитами?
3. Решите задачу. В какой среде (кислой, нейтральной или щелочной) находится изоэлектрическая точка изображенного полипептида? Объясните свой ответ. Н2N-Асп-Иле-Фен-Арг-Вал-Глу-Мет-Про-Тре-Лиз-Асп-Арг-СООН
4. Ответьте на вопросы: 1. Что такое денатурация? Факторы ее вызывающие?
2. Что такое ренатурация?
3. Что такое диализ? Для чего он служит?
4. Что такое изоэлектрическая точка?
5. Заполните таблицу «Факторы, способствующие денатурации белков».
6. Объясните, что лежит в основе методов электрофореза белка и ионообменной хроматографии белков? Для чего эти методы используются?
6. Ответьте на вопросы:
Как влияет рН среды на заряд белков: 1. Обладающих кислыми свойствами? Какие белки обладают кислыми свойствами?
2. Обладающих основными свойствами? Какие белки обладают основными свойствами?
7. Сравните, какой из полипептидов будет лучше растворяться в воде и почему:
Н2N-Лей-Ала-Мет-Вал-Про-СООН или Н2N-Тир-Асп-Тре-Сер-Глу- СООН
9. Решите задачу. Изоэлектрическая точка белка равна 4,7. В каком направлении будут передвигаться молекулы белка в электрическом поле при рН среды, равном 3,57. Объясните ответ. Тестовые задания.
1. Для чего применяется биуретовая реакция в лабораторной практике? 1. Для качественной реакции на белки; 2. Для открытия свободных АМК; 3. Для количественного определения белка; 4. Верно 1,3; 5. Нет верного ответа.
2. Растворимость белка в воде определяется: I. Ионизацией белковых молекул; 2. Гидратацией белковых молекул; 3. Формой молекулы белка; 4. Ионной силой растворителя; 5. Все верно.
3. Денатурация белка сопровождается: 1. Изменением нековалентных связей; 2. Уменьшением растворимости белка; 3. Изменением первичной структуры белка; 4. Верно: 1,2
4. В процессе гидролиза белка: I. Уменьшается количество свободных-СООН-групп; 2. Увеличивается количество свободных аминогрупп; 3. Снижается рН раствора; 4. Образуются новые пептидные связи; 5. Все ответы правильные.
5. Шапероны: 1. Защищают новосинтезированные белки от агрегации; 2. Принимают участие в формировании третичной структуры; 3. Катализируют процесс образования дисульфидных связей; 4. Участвуют в синтезе аминокислот.
6. Что открывает биуретовая реакция? 1. Свободные АМК. 2. Радикалы АМК. 3. Пептидную связь. 4. Все ответы верны. 5. Нет верного ответа
7. Составьте правильные пары, что происходит с белками при высаливании и при денатурации?
8. Указать значение изоэлектрической точки (ИЭТ) для следующего белка:
9. Указать изоэлектрическую точку (ИЭТ) пептида: Ала-Фен-Вал-Три-Мет. 1. рН < 7,0; 2. рН = 7,0; 3. рН > 7,0; 4. Все ответы верны; 5. Нет верного ответа.
10. Указать свойства белка в изоэлектрической точки (ИЭТ): I. Имеет наименьшую растворимость 2. Является анионом. 3. Является катионом; 4. Верно 2,3 5. Нет правильного ответа.
11. При денатурации не происходит: 1. Нарушения третичной структуры; 2. Нарушение вторичной струткуры; 3. Гидролиз пептидных связей; 4. Диссоциации субъединиц.
Методические рекомендации для выполнения внеаудиторной самостоятельной работы к занятию
|
||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 107; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.197.111 (0.008 с.) |

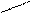 NН3+
NН3+
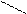
 R NН3+
СОО-
R NН3+
СОО-



