
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
По теме: «химия белка. Биологические функции белков. Аминокислотный состав. Общие свойства и методы их исследования»Содержание книги
Поиск на нашем сайте
Федерального агентства по здравоохранению и социальному развитию»
Кафедра биологической химии
Методические рекомендации Для выполнения САМОСТОЯТЕЛЬНой ВНЕАУДИТОРНой РАБОТы СТУДЕНТОВ лечебного, педиатрического, МЕДИКО-ПРОФИЛАКТИЧЕСКОГО, СТОМАТОЛОГИЧЕСКОГО, ФАРМАЦЕФТИЧЕСКОГО факультетов К ПРАКТИЧЕСКим ЗАНЯТИям По биологической химии
Владикавказ – 2010 СОДЕРЖАНИЕ: Тема: «Химия белка. Биологические функции белков. Аминокислотный состав. Общие свойства и методы их исследования»........................................................................................................... 5
Тема: «Структурная организация белковой молекулы»........................... 12
Тема: «Физико-химические свойства белков»............................................... 19
Тема: «Простые и сложные белки»......................................................................... 26
Тема: «Строение и общие свойства ферментов. Особенности ферментативного катализа. Классификация и номенклатура ферментов»................................................. 33
Тема: «Регуляция активности ферментов. Активаторы и ингибиторы ферментов»........................................................................................... 39
ТЕМА: «Водорастворимые витамины»................................................................... 47
ТЕМА: «Жирорастворимые витамины».................................................................. 55
ТЕМА: «Энергетический обмен. Биологическое окисление»................ 61
Тема: «Общий путь катаболизма - цикл Кребса»............................................. 68
Тема: «Строение и общие свойства углеводов»........................................... 76
Тема: «Переваривание углеводов в желудочно-кишечном тракте, всасывание, транспорт в крови»........................................................................... 81
Тема: Катаболизм глюкозы. Анаэробное окисление глюкозы............ 88
Тема: «Аэробное окисление глюкозы»................................................................ 96
Тема: «Регуляция содержания сахара в крови»........................................... 102
ТЕМА: «Строение и свойства липидов, их классификация, биологическая роль липидов».............................................................................. 111
ТЕМА: «Переваривание и всасывание липидов в желудочно-кишечном тракте. Транспортные формы липидов...... 118
ТЕМА: «Окисление высших жирных кислот и кетоновых тел. Синтез высших жирных кислот и метаболизм кетоновых тел»....... 123
ТЕМА: «Обмен триацилглицеридов. Биосинтез ТАГ. Мобилизация жира из депо. Нарушение обмена ТАГ – ожирение». 129 ТЕМА: «Метаболизм холестерина и его регуляция. Нарушение липидного обмена - атеросклероз»................................................................... 134
ТЕМА: «Липопротеиновый спектр плазмы крови в норме и при патологии. Теории развития атеросклероза. Изменение ЛП – спектра при атеросклерозе».............................................. 140
ТЕМА: «Обмен сложных липидов. Пути биосинтеза сложных липидов. Катаболизм фосфолипидов. Болезни накопления – сфинголипидозы»........................................................................................................... 144
ТЕМА: «Переваривание, всасывание и гниение белков в желудочно-кишечном тракте»............................................................................. 152
ТЕМА: «метаболизм аминокслот. общие пути катаболизма: трансаминирование и декарбоксилирование аминокислот»......... 158
ТЕМА: «пути обезврежинания аммиака в организме. орнитиновый цикл. методы количественного определения мочевины и креатинина в моче»........................................... 164
ТЕМА: «особенности обмена отдельных аминокислот. синтез креатина и креатинина, его количественное определение»..................................................................................................................... 171
ТЕМА: «Обмен нуклеопротеидов. Определение мочевой кислоты в моче (качественные реакции). Пуриновы нуклеопротеиды»............................................................................................................. 179
ТЕМА: «Обмен нуклеопротеидов. Определение мочевой кислоты в моче (качественные реакции). Пиримидиновые нуклеопротеиды»............................................................................................................. 185
ТЕМА: «Обмен хромопротеидов. Распад гема. Определени в крови и моче желчных пигментов»................................................................. 193
ТЕМА: «Нарушения пигментного обмена»........................................................ 200
ТЕМА: «механизм действия белково-пептидных гормонов»............... 208
ТЕМА: «инсулин. гормоны щитовидной железы»........................................ 215
ТЕМА: «стероидные гормоны».................................................................................. 221
ТЕМА: «эндокринопатии»............................................................................................. 227
ТЕМА: «Биохимия крови. Органический состав»......................................... 236
ТЕМА: «Биохимия крови. Электролитный состав»...................................... 242
ТЕМА: «Биохимия мочи. Органический состав мочи. Минеральные компоненты мочи»......................................................................... 247
ТЕМА: «Биохимия мочи. Патологические составные части мочи»......................................................................................................................... 251
Методические рекомендации для выполнения внеаудиторной самостоятельной работы к занятию Задания для работы 1. Заполните таблицу «Классификация аминокислот, основанная на полярности радикалов».
2. Допишите определения: 1. Аминокислота это___________________________________ _________________________________________________________
2. Белки это_________________________________________ _________________________________________________________
3. Напишите формулы всех возможных дипептидов (6) из аминокислот лизина, пролина, глутаминовой кислоты. Назовите их.
4. Напишите формулы протеиногенных аминокислот, имеющих в своем составе гетероциклическое кольцо.
5. Напишите структуру аминокислот: 1. моноаминокарбоновых ____________________________________
2. диаминомонокарбоновых __________________________________
3. моноаминодикарбоновых __________________________________
6. Перечислите свойства аминокислот?
7. Напишите формулы дикарбоновых аминокислот. Дайте им рациональные и тривиальные названия. Обозначьте углеродные атомы греческими буквами.
8. Напишите проекционные формулы D и L-фенилаланина.
9. Перечислите: 1. гомоциклические аминокислоты_____________________________ _________________________________________________________ __________________________________________________________________________
2. гетероциклические аминокислоты___________________________ _______________________________________________________ _______________________________________________________
Тестовые задания. 1. Укажите функции белков:
2. Подберите правильные характеристики АМК: 1. Лиз А. Содержит индольное кольцо 2. Сер Б. Иминокислота 3. Гис В. АМК с (+) зарядом 4. Три Г. Входит в состав коллагеновых белков 5. Про Д. Входит в состав фосфо- и гликопротеи- дов
3. Серосодержащими аминокислотами являются: 1. Треонин; 2. Тирозин; 3. Цистеин; 4. Триптофан; 5. Метионин.
4. Иминокислотой является: 1. Глицин; 2. Цистеин; 3. Аргинин; 4. Пролин; 5. Серин.
5. Подберите правильные характеристики АМК: 1. Гис А. Гидрофильная с анионной группой 2. Лей Б. Гидрофильная с катионной группой 3. Сер В. Гидрофильная незаряженная 4. Лиз Г. Гидрофобная 5. Глу Д. Входит в состав альбуминов 6. Тир 7. Трп
6. Подберите правильные характеристики аминокислот 1.Иле 5.Сер А. Полярная с катионной группой. 2.Асн 6. Про Б. Полярная с анионной группой. 3.Глу 7. Мет В. Полярная незаряженная. 4. Цис 8. Гис Г. Неполярная
7. Подберите правильные характеристики АМК: 1.Лиз А. Содержит индольное кольцо 2.Сер Б. Иминокислота 3.Гис В. АМК с (+) зарядом 4.Трп Г. Входит в состав коллагеновых белков 5. Про Д. Входит в состав фосфо- и гликопротеидов.
8. Подберите правильные характеристики аминокислот 1. Гис А. Гидрофильная с анионной группой 2. Лей Б. Гидрофильная с катионной группой 3. Сер В. Гидрофильная незаряженная 4. Лиз Г. Гидрофобная 5. Глу Д. Входит в состав альбуминов 6. Тир 7. Трп
9. Белки выполняют различные функции, кроме: 1. Структурной; 2. Каталитической; 3. Регуляторной; 4. Генетической; 5. Рецепторной
10. Аминокислоты, имеющие гидрофобный радикал: 1. Тирозин; 2. Аланин; 3. Серин; 4. Треонин; 5. Цистеин.
11. Биполярный ион диаминомонокарбоновой кислоты заряжен: 1. Отрицательно; 2. Положительно; 3. Электронейтрален.
Методические рекомендации для выполнения внеаудиторной самостоятельной работы к занятию Задания для работы. 1. Перечислите химические связи, которые могут возникать между функциональными группами радикалов аминокислот внутри одной полипептидной цепи, а также между отдельными полипептидными цепями в белках.
2. Допишите определение: 1. Олигопептиды - это___________________________________
2. Полипептиды - это____________________________________ _______________________________________________________
3. Дайте определение первичной структуры белков. Какая связь ее стабилизирует? Как эта связь образуется? Приведите пример.
4. Что такое α-спираль и β-структура полипептидной цепи.
5. Охарактеризуйте принцип комплементарности при формировании четвертичной структуры.
6. В образовании третичной структуры белка участвуют связи (отобразить химизм реакции), привести примеры: Ионные______________________________________________________ ____________________________________________________________ Водородные__________________________________________________ ____________________________________________________________ Гидрофобные_________________________________________________ ____________________________________________________________ Дисульфидные________________________________________________ ____________________________________________________________ 7. Напишите и назовите формулы дипептидов, которые могут быть получены из аминокислот: а) треонина и цистеина.
б) фенилаланин и аспарагина.
в) аргинина и лейцина.
8. Какие белки называют глобулярными, а какие фибриллярными?
9. Какие вещества называют пептидами, как обозначаются концы полипептидной цепи.
Тестовые задания. 1. Препятствует образованию α-спирали аминокислотный остаток: 1. Аланина; 2. Серина; 3. Валина; 4. Пролина; 5. Глутамина.
2. Выбрать правильное определение структуры белка:
3. Укажите белки, имеющие четвертичную структуру: 1. Гемоглобин 2. Миоглобин 3. Иммуноглобулины 4. ЛДГ 5. Правильные ответы 1,3,4
4. Первичная структура белка не характеризуется тем, что: 1. В ее формировании участвуют слабые связи; 2. Закодирована генетически; 3. Образована ковалентными связями; 4. Определяет последующие уровни структурной организации. 5. Первичная структура белка не характеризуется тем, что: 1. В ее формировании участвуют слабые связи; 2. Закодирована генетически; 3. Образована ковалентными связями; 4. Определяет последующие уровни структурной организации.
6. Чем обеспечивается структурно-функциональное многообразие природных белков? Выбрать один наиболее правильный и полный ответ из пяти предложенных ниже: 1. Различиями аминокислотного состава; 2. Разной длиной полипептидной цепи; 3. Различиями в молекулярной массе; 4. Различиями последовательности аминокислот в полипептидной цепи; 5. Различиями по количеству полипептидных цепей в олигомерном белке.
7. Выбрать определение третичной структуры белка: 1. Пространственная структура белка, фиксированная водородными связями между атомами пептидного состава; 2. Пространственное расположение полипептидной цепи в определенном объеме, фиксированное связями между радикалами АМК, далеко отстоящих в линейной последовательности; 3. Порядок чередования аминокислот в полипептидной цепи; 4. Пространственное расположение полипептидной цепи, фиксированное пептидными связями; 5. Способ укладки протомеров в олигомерном белке.
8. Выбрать определение вторичной структуры белка: 1. Способ укладки протомеров в олигомерном белке; 2. Последовательность аминокислот, соединенных пептидными связями в полипептидной цепи; 3. Пространственная укладка полипептидной цепи, фиксированной связями между радикалами АМК; 4. Способ укладки полипептидной цепи в виде альфа-спирали и бета-структуры, фиксированной водородными связями между пептидными группами; 5. Объединение нескольких полипептидных цепей в фибриллярные структуры.
9. В формировании третичной структуры белка не участвует связь: 1. Водордная; 2. Пептидная; 3. Дисульфидная; 4. Гидрофобное взаимодействие.
10. Укажите белки, имеющие четвертичную структуру: 1. Гемоглобин 2. Миоглобин 3. Иммуноглобулины 4. ЛДГ 5. Правильные ответы 1,3,4
11. β-структура представляет собой: 1. Тугозакрученную спираль; 2. Зигзагообразную структуру; 3. Встречается только на концах α-спирали, образуя 1-2 витка.
Методические рекомендации для выполнения внеаудиторной самостоятельной работы к занятию Задания для работы. 1. Напишите формулами фрагмент пептида -Глу-Мет-Лиз- Тир-.
а) определите суммарный заряд пептида при рН 7,0, укажите, в какой среде лежит его изоэлектрическая точка;
б) допишите еще 2 аминокислоты, чтобы суммарный заряд пептида был: 1. отрицательный
2. нейтральный
3. положительный
в) на примере одного из написанных пептидов пунктиром покажите один виток α-спирали, назовите связь, стабилизирующую его и группы, которые ее образуют;
г) из написанных пептидов выберите пары аминокислот, способные образовывать связи между радикалами, укажите тип связи, назовите, какой структурный уровень они стабилизируют.
2. Назовите факторы устойчивости белков в растворе. Чем обусловлен заряд белков в растворе? Почему растворимые белки могут быть названы полиэлектролитами?
3. Решите задачу. В какой среде (кислой, нейтральной или щелочной) находится изоэлектрическая точка изображенного полипептида? Объясните свой ответ. Н2N-Асп-Иле-Фен-Арг-Вал-Глу-Мет-Про-Тре-Лиз-Асп-Арг-СООН
4. Ответьте на вопросы: 1. Что такое денатурация? Факторы ее вызывающие?
2. Что такое ренатурация?
3. Что такое диализ? Для чего он служит?
4. Что такое изоэлектрическая точка?
5. Заполните таблицу «Факторы, способствующие денатурации белков».
6. Объясните, что лежит в основе методов электрофореза белка и ионообменной хроматографии белков? Для чего эти методы используются?
6. Ответьте на вопросы:
Как влияет рН среды на заряд белков: 1. Обладающих кислыми свойствами? Какие белки обладают кислыми свойствами?
2. Обладающих основными свойствами? Какие белки обладают основными свойствами?
7. Сравните, какой из полипептидов будет лучше растворяться в воде и почему:
Н2N-Лей-Ала-Мет-Вал-Про-СООН или Н2N-Тир-Асп-Тре-Сер-Глу- СООН
9. Решите задачу. Изоэлектрическая точка белка равна 4,7. В каком направлении будут передвигаться молекулы белка в электрическом поле при рН среды, равном 3,57. Объясните ответ. Тестовые задания.
1. Для чего применяется биуретовая реакция в лабораторной практике? 1. Для качественной реакции на белки; 2. Для открытия свободных АМК; 3. Для количественного определения белка; 4. Верно 1,3; 5. Нет верного ответа.
2. Растворимость белка в воде определяется: I. Ионизацией белковых молекул; 2. Гидратацией белковых молекул; 3. Формой молекулы белка; 4. Ионной силой растворителя; 5. Все верно.
3. Денатурация белка сопровождается: 1. Изменением нековалентных связей; 2. Уменьшением растворимости белка; 3. Изменением первичной структуры белка; 4. Верно: 1,2
4. В процессе гидролиза белка: I. Уменьшается количество свободных-СООН-групп; 2. Увеличивается количество свободных аминогрупп; 3. Снижается рН раствора; 4. Образуются новые пептидные связи; 5. Все ответы правильные.
5. Шапероны: 1. Защищают новосинтезированные белки от агрегации; 2. Принимают участие в формировании третичной структуры; 3. Катализируют процесс образования дисульфидных связей; 4. Участвуют в синтезе аминокислот.
6. Что открывает биуретовая реакция? 1. Свободные АМК. 2. Радикалы АМК. 3. Пептидную связь. 4. Все ответы верны. 5. Нет верного ответа
7. Составьте правильные пары, что происходит с белками при высаливании и при денатурации?
8. Указать значение изоэлектрической точки (ИЭТ) для следующего белка:
9. Указать изоэлектрическую точку (ИЭТ) пептида: Ала-Фен-Вал-Три-Мет. 1. рН < 7,0; 2. рН = 7,0; 3. рН > 7,0; 4. Все ответы верны; 5. Нет верного ответа.
10. Указать свойства белка в изоэлектрической точки (ИЭТ): I. Имеет наименьшую растворимость 2. Является анионом. 3. Является катионом; 4. Верно 2,3 5. Нет правильного ответа.
11. При денатурации не происходит: 1. Нарушения третичной структуры; 2. Нарушение вторичной струткуры; 3. Гидролиз пептидных связей; 4. Диссоциации субъединиц.
Методические рекомендации для выполнения внеаудиторной самостоятельной работы к занятию Исходный уровень знаний: · Понятие о белковой молекуле, структурная организация белков · Общая характеристика простых и сложных белков. · Основные физико-химические свойства белков.
Задания для работы. 1. Дать определение: Простые белки – это_________________________________________ Сложные белки – это_________________________________________
2. Изобразите классификацию белков в виде схемы.
3. Вставьте пропущенные слова:
1. Нуклеопротеиды – это ______________ белки, которые в качестве простетической группы (_______________ компонента) содержат _________________.
2. Нуклеиновая кислота – это____________, мономером которого является _____________.
4. Закончите фразу: Различают 2 типа нуклеопротеидов ____________________ и____________________ Дезоксирибонуклеопротеиды – это ________________________________ _____________________________________________________________
Рибонуклеопротеиды – это ______________________________________ ____________________________________________________________
5. Изобразите схематически строение мононуклеотида. Напишите структуру АМФ.
6. Решите задачу. Кислород необходим клеткам для процессов окисления веществ и получения энергии. Недостаток кислорода, так же как и его избыток, губителен для тканей. Каким образом регулируется количество кислорода, доставляемого в ткани в точном соответствии с клеточными потребностями? При ответе объясните: а) механизм функционирования гемоглобина;
б) что такое эффект Бора;
в) как связан этот эффект с метаболической активностью тканей;
г) как изменится количество поступающего в ткани кислорода при алкалозе.
7. Проведите анализ: Чем отличаются от нормального гемоглобина карбоксигемоглобин и метгемоглобин? В каких случаях они образуются в организме человека?
8. Назовите представителей: 1. фосфопротеидов__________________________________________ _____________________________________________________________
2. металлопротеидов_________________________________________ _____________________________________________________________
3. гликопротеидов___________________________________________ _____________________________________________________________
№9. Решите задачу. Мутация, приводящая к замене аминокислоты Глу на Вал в положении 6 β-цепей гемоглобина вызывает тяжелое наследственное заболевание серповидноклеточную анемию, делающее не возможными интенсивные физические нагрузки. Эритроциты людей с таким заболеванием имеют форму серпа. Объясните молекулярные механизмы возникновения этого заболевания. Для этого: а) дайте определение понятию «первичная структура белка»;
б) охарактеризуйте все уровни пространственной организации гемоглобина;
в) напишите формулы аминокислот, находящихся в положении 6 НЬА (норма) и HbS (патология) и укажите их свойства;
г) объясните, как повлияет введение Вал на свойства и функцию молекулы гемоглобина.
Тестовые задания. 1. Гемоглобин эритроцитов матери или плода при физиологических условиях обладает более высоким сродством к кислороду: 1. Нb A 2. Hb F
2. Указать причину увеличения сродства Нb к О2 при оксигенации Нb. 1. Изменение третичной структуры протомеров; 2. Изменение связей в четвертичной структуре; 3. Изменение взаимоположения протомеров; 4. Кооперативные взаимодействия протомеров; 5. Изменение'расположения гема в НЬ.
3. Миоглобин относится к: 1. Металлопротеинам; 2. Гемопротеинам; 3. Липопротеинам; 4. Гликопротеинам; 5. Флавопротеинам.
4. Освобождение О2 из оксигенированного Нb в периферических тканях усиливается: 1. Повышением концентрации Н+; 2. Повышением концентрация СО2; 3. Повышением концентрации 2,3-дифосфоглицерата (ДФГ). 4. Все ответы верны. 5. Нет верного ответа.
5. Миоглобин и гемоглобин: 1. Участвуют в доставке О2 из легких в ткани; 2. Обеспечивают внутриклеточный транспорт О2; 3. Имеют идентичную первичную структуру; 4. Присоединяют 4 молекулы О2; 5. Являются сложными белками.
6. Сколько типов нуклеопротеинов отличающихся друг от друга по составу, размерам и физико-химическим свойствам в природе обнаружено? 1. 2 2. 18 3. 4 4. 87 5. 21
7. Подберите правильные сочетания: 1. нуклеопротеины 2. фосфопротеиды 3. липопротеины 4. гликопротеины
а. в своем составе имеет углеводный компонент б. содержат органически связанный, лабильный фосфат в. простетическая группа представлена каким-либо липидом г. состоят из белка и нуклеиновых кислот
8. Дезоксирибонуклеопротеины преимущественно локализуются: 1. в рибосомах; 2. в цитоплазме; 3. в ядре;
9. Флавопротеиды: 1. медь содержащие бели; 2. в основе структур простетической группы лежит изоаллоксазиновое кольцо; 3. к белкам этого класса относятся козеиноген молока, вителлин; 4. производные витамина В2.
10. Аденин входит в состав: 1. Только РНК; 2. Только ДНК; 3. РНК и ДНК.
11. В состав РНК не входит азотистое основание: 1. Тимин; 2. Цитозин; 3. Урацил; 4. Гуанин; 5. Аденин.
Методические рекомендации для выполнения внеаудиторной самостоятельной работы к занятию Установите соответствие. 8. Составьте пары между ферментами и соответствующим применением в клинике 1. Трипсин/химотрипсин. А. Лечение вирусных заболеваний. 2. Гиалуронидаза. Б. Разрушение тромбов. 3. Урокиназа/стрептокиназа. В. Обработка гнойных и ожоговых 4. Нуклеазы:(ДНК-азы,РНК-азы). ран. 5. Цитохром «С». Г. Рассасывание спаек соедини тельной ткани и рубцов кожи. Д. При заболеваниях сердечно-сосудистой системы, сахарном диабете и др., характеризующихся развитием тканевой гипоксии.
9. А. Стимулирует секрецию фермента в кровь. Б. Сопровождается изменением количества протомеров в белке. В. Изменяет первичную структуру белка. Г. Снижает заряд и изменяет конформацию фермента. Д. Уменьшает количество фермента в клетке.
1. Частичный протеолиз. 2. Ассоциация – диссоциация. 3. Дефосфорилирование.
10. Механизм действия: А. Ингибитор вступает в ковалентное взаимодействие с определенной структурой фермента Б. Ингибитор конкурирует с субстратом за взаимосвязь с активным центром В. Ингибитор не взаимодействует с активным центром, а с другой частью молекулы Тип ингибитора: 1. Обратимый конкурентный. 2. Обратимый неконкурентный. 3.Необратимый.
11. Сравните взаимодействие субстрата и аллостерического эффектора с ферментом
Ответы№1 №1. 1-А; 2-В,Д; 3-Г, В. №2. 1-А; 2-Г, В; 3-Б. №3. Б, В, Г, Д. №4. 1. №5. 1. №6. 3,4. №7. 8. №8. 2. №9. 1. №10. 1, 2, 5. №11. 4. Ответы№2
№1. 1, 2, 3, 5. №2. 1, 2, 3, 4. №3. 1, 2, 3. №4. 3. №5. В, Г, Д. №6. А, Б,В, Г, Е. №7. 1,2. №8. 1-В, 2-Г, 3-Б, 4-А, 5-Д. №9. 1-Б, В, Г; 2-Б,Г; 3-Г. №10. А-3, Б-1, В-2. №11. 1-В, 2-А, 3-С, 4-Д.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ДЛЯ ВЫПОЛНЕНИЯ ВНЕАУДИТОРНОЙ САМОСТОЯТЕЛЬНОЙ РАБОТЫ К ЗАНЯТИЮ ПО Исходный уровень знаний. · Витамины – незаменимые органические микроэлементы пищи · Витамины – важные компоненты коферментов в простетических группах ферментов
Задания для работы:
1. Зарисуйте и заполните таблицу по указанным водорастворимым витаминам
2. Зарисовать и заполнить таблицу по водорастворимым витаминам (В1, В2, В6, РР, С):
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 239; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.46.87 (0.016 с.) |

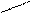 NН3+
NН3+
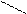
 R NН3+
СОО-
R NН3+
СОО-



