
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классическая и квантово-механическая теории строения молекул.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Основы классической теории строения молекул разработаны во второй половине 19 века. Франкланд – представления о химической связи и валентности, Купер – графические формулы, Кекуле – цепочки атомов углерода, четырехвалентность углерода в органических соединениях. Разработка общей и последовательной классической теории строения молекул связана с именем Бутлерова. Бутлеров исходил из представления о молекуле как связанной совокупности неких (эффективных) атомов. Все взаимодействия атомов в молекуле он разделил на две группы: главные взаимодействия – сейчас мы называем их химическими связями, и дополнительные взаимодействия – взаимные влияния атомов, непосредственно не связанных главными взаимодействиями. При описании главных взаимодействий – химических связей Бутлеров опирался на представления об единицах сродства и валентности атомов в молекуле. Он обосновал представление о кратных связях. Бутлеров рассматривал молекулу как динамическое образование. Намеченная им принципиальная программа развития теории предполагала рассмотреть как внутреннее движение эффективных атомов в молекуле (колебаний атомов в молекуле), так и вращение молекулы как целого. После установления ядерно-электронного строения атомов и молекул, были сделаны многочисленные попытки описать их, опираясь на понятия и законы классической физики. В частности, была развита классическая теория колебаний многоатомных молекул, т.е. теория колебаний ядер около положений равновесия. Некоторые свойства молекул качественно, а частично и количественно, описаны на основе классической теории. Но описание возможных состояний отрицательного заряда в молекуле – электронных состояний молекулы совершенно не могло быть проведено на основе классической физики. Знание классической теории в приложении к молекулам важно по следующим причинам. Результаты квантово-механической теории могут быть поняты глубже и полнее, если классическая теория известна. Кроме этого, классическая теория позволяет правильно решить некоторые вопросы строения молекул. От классических выражений физических величин для молекулы легко перейти к соответствующим квантово-механическим операторам. Наконец, некоторые формы выражений физических величин в классической теории и квантовой механике формально тождественны. Однако в классической теории нет уравнений, позволяющих получить правильное выражение для электронной плотности в атоме или молекуле.
Фундаментальное значение для развития теории строения молекул имела идея Планка о квантовании излучения. Эта идея лежала в основе промежуточного этапа в развитии теории строения атома – модели Бора-Зоммерфельда. Эта теория полностью объяснила атом водорода, но оказалась неприменимой к многоэлектронным атомам и молекулам. Проблема строения атомов и молекул была принципиально решена с созданием квантовой механики работами Де-Бройля, Шредингера, Дирака, Борна, Гейзенберга, Паули в 20-х годах 20 века. Квантовая механика позволила описать строение ядерно-электронных систем и принципиально дала методы расчета их свойств. Понятие «Квантовая химия» несколько уже понятия «Квантовая механика», так как объектами квантовой химии являются атомы и молекулы. В настоящее время разработан ряд квантово-механических методов решения соответствующих задач квантовой химии. Применение мощных ЭВМ позволяет количественно рассчитать не только основные, но и тонкие особенности строения и свойств атомов и молекул. Таким образом, квантовая механика является основой современной теоретической химии.
Тема 1. Классическая модель молекулы. Основные понятия. Важно, что в классической модели атома или молекулы электроны никогда явным образом не рассматриваются. В классической теории молекула рассматривается как совокупность «эффективных атомов»: молекула существует как единое целое благодаря взаимодействиям между эффективными атомами – главными и дополнительными. Слово «эффективный» употребляется для того, чтобы подчеркнуть, что атом в составе молекулы отличается от свободного атома. Если ядро у эффективного и свободного атомов одно и то же, то электронные оболочки существенно различаются по своей форме, а иногда и по количеству электронов. Таким образом, у каждого эффективного атома существует положительно заряженное ядро, массу эффективного атома можно считать сосредоточенной в ядре и принять это ядро за центр эффективного атома.
В дальнейшем для краткости вместо термина «эффективный атом» будем использовать «атом».
|
||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 1175; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.114.102 (0.011 с.) |

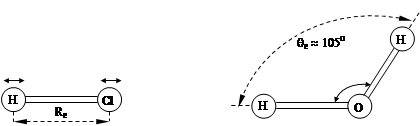 Молекула как целое может двигаться поступательно и вращаться относительно какой либо внешней системы координат, принятой за неподвижную. Части молекулы также находятся в движении. Во-первых, эффективные атомы совершают колебания около некоторых положений – положений равновесия. Например:
Молекула как целое может двигаться поступательно и вращаться относительно какой либо внешней системы координат, принятой за неподвижную. Части молекулы также находятся в движении. Во-первых, эффективные атомы совершают колебания около некоторых положений – положений равновесия. Например: Во-вторых, одни группы эффективных атомов молекулы могут совершать крутильные колебания или вращаться по отношению к другим группам атомов (внутреннее вращение). Например, в молекуле этана одна метильная группа может вращаться вокруг С-С связи относительно другой метильной группы.
Во-вторых, одни группы эффективных атомов молекулы могут совершать крутильные колебания или вращаться по отношению к другим группам атомов (внутреннее вращение). Например, в молекуле этана одна метильная группа может вращаться вокруг С-С связи относительно другой метильной группы.


