
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронные спектры двухатомных молекул.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Если чисто вращательные спектры наблюдаются только у молекул, обладающих постоянным электрическим дипольным моментом, а для наличия колебательных спектров необходимо, чтобы при колебании молекулы изменяется ее дипольный момент, то электронные спектры наблюдаются у всех молекул, т.к. изменение распределения электронов в молекуле всегда сопровождается изменением ее дипольного момента. Это означает, что гомоядерные молекулы, например H2 или N2, не имеющие ни вращательных, ни колебательно-вращательных спектров, обязательно проявятся в электронном спектре, из характерной колебательной и вращательной структуры которого можно найти и вращательные постоянные и частоты колебаний. Пренебрежем тонкой вращательной структурой и рассмотрим грубую колебательную структуру электронных спектров, т.е. запишем энергию молекулы в виде eполн = eэл + eкол
или eполн = e+ wе(v+ При переходе между электронными состояниями по существу не действуют никакие правила запрета по v, то есть каждый переход v²® v¢ имеет конечную вероятность, и поэтому в спектре следует ожидать появления большого числа спектральных линий. Ситуация заметно упрощается, если рассматривать спектр поглощения только из основного электронного состояния. В этом случае, практически все молекулы находятся и в самом нижнем колебательном состоянии, то есть v²=0, и поэтому заметную интенсивность будут иметь лишь переходы, указанные на рисунке. Такой набор переходов называется полосой (при низком разрешении прибора каждая из линий этого набора будет казаться широкой и размытой (вращательная структура проявится лишь при высоком разрешении)). Как видно из рисунка, линии сближаются между собой с ростом частоты; это является прямым следствием ангармоничности высоких колебательных состояний, которая и обуславливает схождение возбужденных колебательных уровней. Аналитическое выражение для этого спектра
Отсюда видно, что если в полосе наблюдается хотя бы 5-6 линий, то по их положению в спектре можно найти У молекулы обычно имеется много возбужденных электронных состояний и поэтому полный спектр поглощения гораздо сложнее представленного на рисунке. Из основного состояния переходы могут происходить в несколько возбужденных, и каждый такой переход дает в спектре свою полосу, подобную изображенной на рисунке.
Спектриспускания обусловлен переходами молекулы, предварительно возбужденной в одно из возможных
|
||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 690; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.100.31 (0.01 с.) |


 ) - wехе (v+
) - wехе (v+ 

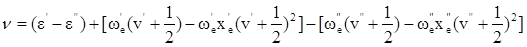
 и
и 
 - состояний, во многие
- состояний, во многие  - состояния. Поэтому спектры испускания имеют обычно очень сложную структуру.
- состояния. Поэтому спектры испускания имеют обычно очень сложную структуру.


