Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биохимия, её задачи. Значение биохимия для медицины.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Биохимия, её задачи. Значение биохимия для медицины. Биохимия относится к фундаментальным дисциплинам медицины и биологии. В результате научного познания мира выделился ряд фундаментальных дисциплин: философия, физика, химия, биология и д.р. Биохимия выделилась с одной стороны в результате разделения наук. Ей не доставало точности, т.к. длительно она была описательной наукой. Середина 20 в. ознаменовалась глобальными открытиями в физике. В это же время интеграция биологии с точными науками способствовала её бурному развитию. Биохимия возникла как наука, благодаря привлечению в биологию точных знаний, в частности химии. Биохимия—наука о структуре веществ, входящих в состав живого организма, их превращениях и физико-химических процессах, лежащих в основе жизнедеятельности. Выделяют три составных компонента общей биохимии: 1.Статическая биохимия (изучает структуру веществ- строение) - биоорганическая химия. 2.Динамическая биохимия (изучает превращение веществ в организме). 3.Функциональная биохимия (изучает процессы, лежащие в основе функций органов и тканей). Кроме общей (базисной) биохимии выделяют ещё ряд разделов биохимии, в зависимости от направления проводящихся исследований: 1.Биохимия растений. 2.Биохимия микроорганизмов. 3.Биохимия животных. 4.Медицинская биохимия. 5.Ветеринарская биохимия. 6.Техническая биохимия. 7.Биохимия генетики. 8.Молекулярная биохимия. Биохимия тесно связана с фармацевтическими науками: фармакогнозией, фармакологией, биотехнологией. Фармакогнозия изучает химические процессы в растениях. Фармакология – биохимическая основа понимания действия лекарственных соединений в организме. Биотехнология – помогает понять явления происходящие в процессе производства некоторых лекарственных средств. Задачи биохимии: 1 – Установить строение соединений, входящих в состав организма и по химическому строению понять функции данного соединения в организме. 2 – Изучить превращение веществ в организме, выяснить роль происходящих процессов. 3 – Изучить связь превращений с Функциями органов и систем. Аминокислоты, их классификация. Строение и биологическая роль аминокислот. Аминокислоты – гетерофункциональные соединения. Они являются производными карбоновых кислот, у которых атом водорода в альфа-положении замещён на аминогруппу. Строение: Общая структурная особенность аминокислот - наличие амино- и карбоксильной групп, соединённых с одним и тем же α-углеродным атомом. R - радикал аминокислот - в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение. В водных растворах при нейтральном значении рН α- аминокислоты существуют в виде биполярных ионов. 19 из 20 аминокислот содержат в α-положении асимметричный атом углерода, с которым связаны 4 разные замещающие группы. В составе белков присутствуют только L-изомеры аминокислот. Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к α-углеродному атому. Классификация: По химической природе боковой цепи (алифатические, ароматические, гетероциклические): I. Алифатические 1. Моноаминомонокарбоновые: Глицин; Аланин; Валин; Лейцин; Изолейцин; `Алифатические с дополнительной функциональной группой: 1. Оксиаминокислоты: Серин; Треонин; 2. Моноаминодикаробоновые: Аспарагиновая кислота; Глутаминовая кислота; 3. Содержащие амидную группу: Аспарагин; Глутамин; 4. Диаминомонокарбоновые: Лизин; Аргинин; 5. Серусодержащие: Цистеин; Цистин; Метионин; II. Ароматические Фенилаланин; Тирозин; III. Гетероциклические: Гистидин; Триптофан; IV. Иминокислота: Пролин; По Ленинджеру (по способности радикала взаимодействовать с водой) все аминокислоты делят на 4 группы: 1. Неполярные, незаряженные (гидрофобные) – их 8: ала, вал, лей, иле, мет, фен, три, про; 2. Полярные, незаряженные (гидрофильные) – их 7: сер, тре, глн, асн, цис, тир, гли; 3. Отрицательно-заряженные – их 2: асп, глу; 4. Положительно-заряженные – их 3: гис, арг, лиз.
По способности синтезироваться в организме аминокислоты могут быть:
1. Заменимые (могут синтезироваться в организме): ала, асп, глу, гли, асн, глн, про, сер; 2. Частично заменимые: арг, гис; 3. Условно заменимые: тир, цис; 4. Незаменимые: фен, мет, тре, три, вал, лиз, лей, иле;
Функции аминокислот: 1. входят в состав всех белков 2. входят в состав других соединений 3. являются промежуточными метаболитами обменных процессов (например, орнитин, цитруллин),
4. необходимы для синтеза биологически активных соединений, например, биогенных аминов, нейромедиаторов, необходимы для синтеза азотсодержащих соединений (полиаминов, нуклеотидов и НК), 5. углеродный скелет аминокислот может использоваться для синтеза других соединений: а) глюкозы – такие аминокислоты называются глюкогенными (большинство из протеиногенных), б) липидов – кетогенными (вал, лей, иле, фен, тир), аминокислоты могут быть источником определенных функциональных групп – сульфатной (цистеин), одноугле-родных фрагментов (метионин, глицин и серин), амино-группы (глутамин, аспарат).
Гидратация – способность связывать воду. 100 грамм белка связывает 30-35грамм воды. Вода связывается с ионогенными и пептидными группами, расположенными, в основном, внутри молекулы белка. Проникновение воды внутрь белка – набухание. Связывание воды ионогенными группами, расположенными на поверхности белковой молекулы, приводит к образованию гидратной оболочки. Растворимость Определяется зарядом молекулы и наличием гидратной оболочки. Для осаждения белка используется метод высаливания – осаждение с помощью нейтральных солей ((NH4)2SO4, KCl, NaCl). В полунасыщенном растворе (NH4)2SO4 высаживаются глобулины, а в насыщенном альбумины. При воздействии внешних факторов может происходить нарушение сложных уровней структурной организации с сохранение первичной структуры. Такой белок теряет свои нативные свойства, а процесс потери физико-химических свойств под действие неблагоприятных факторов (давления, температуры, ультразвука и т.д.) – денатурация. В некоторых случаях, при непродолжительном воздейсвии возможна ренатурация. Шапероны – класс белков, защищающий в условиях клетки другие белки от денатурации. Они облегчают формирование пространственной конфигурации белков.
Простые белки. Гистоны – тканевые белки связанные с ДНК хроматина и имеющие небольшую молекулярную массу (11-24тыс.Да) По электрохимическим свойствам – основные. Имеют только третичную структуру, сосредоточены в основном в ядрах клеток. Гистоны связаны с ДНК в составе дезоксирибонуклеопротеинов. Связь гистон-ДНК электростатическая. В составе гистонов преобладают диаминокарбоновые аминокислоты. Выделяют 5 типов гистонов по соотношению лиз и арг. 4 гистона образуют белковый комплекс – нуклеосомный кор, молекула ДНК накручивается на поверхность гистонового октамера и получается структурная единица хроматина – нуклеосома. Основная функция гистонов – структурная и регуляторная. Структурная – учавствуют в стабилизации пространственной структуры ДНК. Регуляторная – способность блокировать передачу генетической информации от ДНК к РНК. Протамины – своеобразные биологические заментители гистонов, отличаются от них составом и структурой. Это самые низкомолекулярные белки (М= 4-12тыс.Да), из-за большого содержания арг – основные. Они связываются с ДНК в хроматине спермиев. Протамины делают компактной ДНК сперматозоидов т.е. выполняют только структурную функцию. Альбумины – белки М=15-70тыс.Да, имеют отрицательный заряд и кислые свойства, содержат много глу. Сильно гидратированные белки и осаживаются только при высокой концентрации водоотнимающих веществ. Из-за высокой гидрофильности и малым размерам они играют важную роль в поддержании осмотического давления крои. А благодаря высокой адсорбционной способности они выполняют транспортную функцию (гормоны, холестерол, билирубин, лекарственные вещества). Глобулины – слабокислые или нейтральные белки с чуть большей М, чем альбумины. Некоторые из них специфические переносчики.
Первичная структура ДНК. - порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинуклеотидной цепи, связь между мономерами обозначают 3,5-фосфодиэфирной. Линейная последовательность дезоксирибонуклеотидов записывают однобуквенным кодом от 5` к 3` концу. Вторичная структура ДНК. ДНК имеет форму двойной правозакрученной спирали, полинуклеотидные цепи в ней антипараллельны. Все основания цепей ДНК расположены внутри двойной спирали, а пентозофосфатный остов – снаружи. Полинуклеотидные цепи удерживаются относительно друг друга за счёт водородных связей между комплементарными пуриновыми и пиримидиновыми основаниями (A=Т, Г≡Ц). При этом число пуриновых оснований равно числу пиримидиновых. Между основаниями двухцепочечной молекулы возникают гидрофобные взаимодействия, стабилизирующие её. Нуклеопротеины - это сложные белки, небелковая часть которых представлена нуклеиновыми кислотами. Нуклеопротеины делятся на: Рибонуклеопротеины и дезоксирибонуклеопротеины. Их белковая часть содержит простые белки – протамины и гистоны. Гемоглобин. Имеет четвертичную структуру М=66-68 тыс.Да. Он представлен соединением гема с белком глобином. Это олигомерный белок состоящий из 4х субъединиц. Субъединицы узнают друг друга благодаря комплементарным участкам на их поверхности. Каждая из субъединиц обозначается буквами, их 4: у взрослого (HbA) – содержит 2 альфа и 2 бета цепи. Комплексообразователем протомеров является Fe2+, который связан с 6 лигандами: 4 лиганда – пирольные кольца протопорфина, 1 – с белком глобином через гистидин, 1- для связывания с О2, СО2, СО. Основная функция гемоглобина – перенос кислорода из легких к периферическим тканям. Первая молекула кислорода изменяет конформацию протомера→ изменяется конформация и сродство других протомеров – это явление называется кооперативностью изменения конформации протомеров. Это приводит к тому, что сродство ко 2,3 и 4ой молекуле кислорода увеличивается. При соединении с СО образуется карбоксигемоглобин, при этом гемоглобин имеет большее сродство к угарному газу, нежели к кислороду. Присоединение СО2 приводит к образованию карбгемоглобина. Типы гемоглобинов Физиологические типы: · Примитивный HbP - появляется на самых ранних стадиях развития эмбриона – тетрамер (2α,2ε). · Фетальный HbF – главный тип гемоглобина плода (2α,2γ) · Гемоглобин Взрослого НbA(2α,2β), HbA2(2α,2σ), HbA3 – появляется в на более поздних стадиях развития плода, у взрослого составляет около 95% Аномальные типы: · Серповидно-клеточный HbS обнаруживается при серповидно-клеточной анемии, когда глутаминовая кислота в β-субъединицах заменяется валином. После отдачи кислорода в ткани гемоглобин начинает выпадать в осадок, что деформирует клетку и приводит к гемолизу. Эритроциты при этом, в условиях низкого парциального давления принимают форму серпа.
Миоглобин. Также относится к хромопротеинам, это белок имеющий третичную структуру. Функции миоглобина и гемоглобина схожи т.е. оба участвуют в транспорте О2. Миоглобин присоединяет О2, доставленный гемоглобином и служит промежуточным звеном в транспорте О2 к митохондриям и запасает О2 в тканях, создавая кислородный резерв. В условиях интенсивной мышечной работы О2 освобождается и используется в митохондриях клеток для получения энергии необходимой для работы мышц.
Свободные липопротеины Содержатся в плазме крови, имеют разную плотность благодаря липидному компоненту. В крови человека присутствуют фракций ЛП, отличных по плотности. Липопротеины плазмы крови: А) Хиломикроны (ХМ) – самая низкая по плотности фракция, в их составе преобладают липидные комплексы, на доле белка до 2%. Плотность 0,95 кг/л. Хиломикроны появляются в сыворотке крови после приёма жирной пищи; Б) Липопротеины очень низкой плотности (ЛПОНП) транспортируют эндогенные триглицериды, фосфолипиды, холестерин и эфиры холестерина. Таким образом, ЛПОНП выполняют роль переносчика липидов в организме. Плотность 0,94-1,006 кг/л. В) Липопротеины низкой плотности (ЛПНП) образуются из ЛПОНП в процессе гидролиза последних под действием сначала липопротеинлипазы, а затем печёночной липазы. При этом относительное содержание триглицеридов в частице заметно падает, а холестерина растёт. Таким образом, ЛПНП являются завершающим этапом обмена эндогенных (синтезированных в печени) липидов в организме. Они переносят в организме холестерин, а также триглицериды, каротиноиды, витамин Е и некоторые другие липофильные компоненты. Плотность 1,006- 1,063 кг/л. Г) Липопротеины высокой плотности (ЛПВП) в их составе преобладает белковый компонент. ЛПВП обладают антиатерогенными свойствами. Так как высокая концентрация ЛПВП существенно снижает риск атеросклероза и сердечно-сосудистых заболеваний, холестерин ЛПВП иногда называют «хорошим холестерином» (альфа-холестерином) в отличие от «плохого холестерина» ЛПНП, который, наоборот, увеличивает риск развития атеросклероза. ЛПВП обладают максимальной среди липопротеинов плотностью из-за высокого уровня белка относительно липидов. Частицы ЛПВП — наиболее мелкие среди липопротеинов, 8-11 нм в диаметре. Плотность 1,063- 1,210 кг/л. Свободные ЛП играют транспортную роль, поэтому их называют – транспортными формами липидов. Благодаря растворимости в водной среде они могут переносить липиды, поступающие в кровь при всасывании из кишечника, а также распределять липиды между тканями. ЛП переносят триацилглицеролы, фосфолипиды, стероиды, а также небольшое количество жирорастворимых витаминов, β-каротина. Структурные протеолипиды Они входят в состав биологических мембран и растворяются в неполярных растворителях. Это обусловлено тем, что белок составляет сердцевину молекулы, а оболочка – липидный компонент. Содержание белка 65-85%. Они обнаружены в сердце, почках, легких, скелетных мышцах – образуя двойной липидный слой биологических мембран.
СТРОЕНИЕ ФЕРМЕНТОВ. В пространственной структуре фермента можно выделить отдельные участки, которые выполняют те или иные функции (активный центр, контактный участок, каталитический участок, АЛЛОСТЕРИЧЕСКИЙ центр). Активный центр - это участок в молекуле фермента, где происходит связывание и превращение субстрата. Он обычно располагается в гидрофобном углублении (недоступном для молекул воды), изолируя субстрат от воды. В образовании активного центра участвуют боковые группы АК, причём эти АК могут находиться на разных участках полипептидной цепи, но при формировании пространственной конфигурации фермента они укладываются т.о., что располагаются в области активного центра. В образовании активного центра принимают участие следующие группы боковых цепей АК: - NH2 (АРГ,ЛИЗ) - СООН (АСП, ГЛУ) - SH (ЦИС) - ОН (СЕР,ТРЕ) - ИМИДАЗОЛ (ГИС) - ГУАНИДИНО группа Фенольное кольцо (ТИР) Остальные АК поддерживают пространственную конфигурацию активного центра фермента и обеспечивают его реакционную способность. Контактный участок (субстратная площадка) - это место в активном центре фермента, где происходит связывание субстрата с его активным центром. Контактный участок обеспечивает специфическое сродство субстрата к ферменту. Каталитический участок – место в активном центре, где проходит сама каталитическая реакция. Аллостерический (регуляторный) центр - участок в молекуле фермента, расположенный вне активного центра. К аллостерическому центру могут присоединяться различные вещества, которые отличаются по структуре от молекул субстрата – регуляторы (аллостерические эффекторы). Они могут влиять на конформацию активного центра фермента. В роли регуляторов чаще всего выступают гормоны, лекарственные вещества и др. химические соединения.
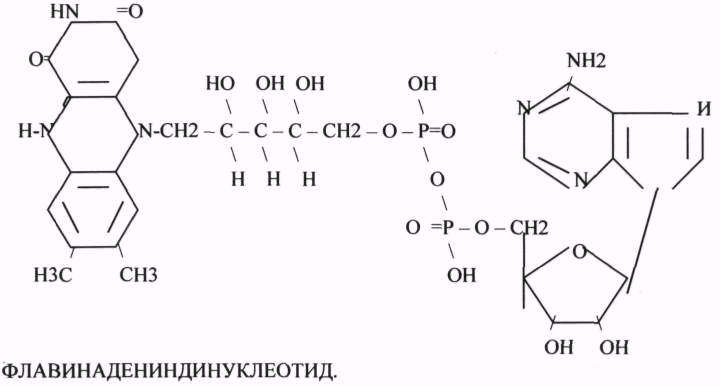
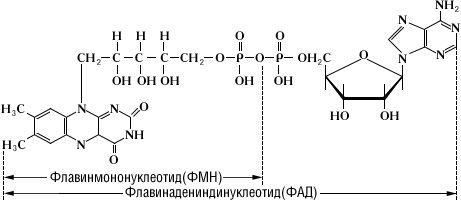
Коферменты и их функции в ферментативных реакциях. Витаминные коферменты. Примеры реакций с участием витаминных коферментов. Тиаминовые коферменты, ТДФ. Коферменты - низкомолекулярные органические вещества не белковой природы. Коферменты являются или акцепторами, или донорами различных атомов, или даже атомных групп. Они чаще всего содержат в своём составе различные витамины, следовательно, их делят на две группы: 1.Витаминные. 2.Невитаминные. Витаминные коферменты: Флавиновые коферменты содержат в своём составе витамин В 2. 1.ФМН - ФЛАВИНМОНОНУКЛЕОТИД. 2.ФАД - ФЛАВИИАДЕНИНДИНУКЛЕОТИД. ФАД*Н2
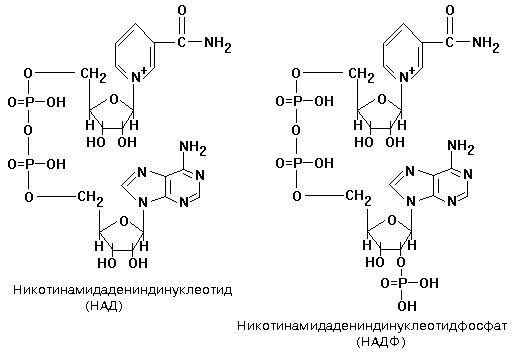
ФМН и ФАД связанны с ферментами ДЕГИДРОГЕНАЗАМИ. Участвуют в реакциях ДЕГИДРИРОВАНИЯ. Пантотеиновые коферменты содержат в своём составе витамин ВЗ (ПАНТОТЕИНОВАЯ К-ТА). KO-F A (HSK.O-A - HS КОЭНЗИМ А). КОФЕРМЕНТ АЦИЛИРОВАНИЯ. Никотинамидные коферменты содержат в своём составе витамин РР (НИАЦИН). 1.НАД (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИД). 2.НАДФ (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ).
НАД и НАДФ также связаны с ферментами ДЕГИДРОГЕНАЗАМИ, которые в окислительно-восстановительных реакциях (реакции ДЕГИДРИРОВАНИЯ) - анаэробные ДГ. Пиридоксиновые коферменты содержат в своём составе витамин В6. ПАФ - ПИРИДОКСАМИНОФОСФАТ. ПФ - ПИРИДОКСАЛЬФОСФАТ. Участвует в реакциях превращения АК: 1.Реакции ПЕРЕАМИНИРОВАНИЯ (ТРАНСАМИНИРОВАНИЕ). Связан с ферментами АМИНОТРАНСФЕРАЗАМИ. 2.РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ АК. Невитаминные коферменты: Не содержат в своём составе витаминов, но участвуют в каталитических превращениях. 1.НУКЛЕОТИДЫ: АТФ, ЦТФ (синтез ФОСФОЛИПИДОВ); УДФ, УТФ, ГТФ (синтез ГЛИКОГЕНА). 2.ПРОИЗВОДНЫЕ ПОРФИРИНА: ГЕМ, ЦИТОХРОМЫ, КАТАЛАЗА. 3.ПЕПТИДЫ: ГЛУТАТИОН – ТРИПЕПТИД, содержащий ГЛУ-ЦИС-ГЛИ. Он связан с ферментами ОКСИДОРЕДУКТАЗАМИ. Участвует в окислительно-восстановительных реакциях. Тиаминовые коферменты, ТДФ. Никотинамидные коферменты. Структура НАД, НАДФ. Примеры реакций. Никотинамидные коферменты - коферментные формы никотиновой кислоты (витамина PP). Включают НАД (никотинамидадениндинуклеотид), НАДФ (никотинамидадениндинуклеотидфосфат), НАДН (восстановленный НАД), НАДФН (восстановленный НАДФ). Никотинамидные коферменты - коферменты дегидрогеназ - промежуточные акцепторы и переносчики электронов и водорода.
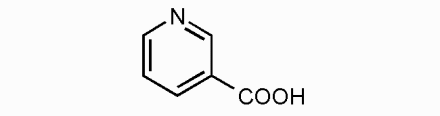
Никотиновая кислота 1.Кофермент дегидрогеназ
2. Компонент дыхательной цепи
Флавиновые коферменты. Структура ФМН,ФАД. Примеры реакций. Флавиновые коферменты ФМН (FMN) и ФАД (FAD) найдены в дегидрогеназах, оксидазах и монооксигеназах. Обычно оба соединения ковалентно связаны с ферментами. Активной группой обоих коферментов является флавин (изоаллоксазин), имеющий сопряженную систему из трех колец, которая может при восстановлении принимать два электрона и два протона. Предшественник – витамин В2 – рибофлавин. ФАД состоит из ФМН, связанного с АМФ. Оба соединения являются функционально близкими коферментами.
Рибофлавин 1.Кофермент дегидрогеназ
2.Компонент дыхательной цепи
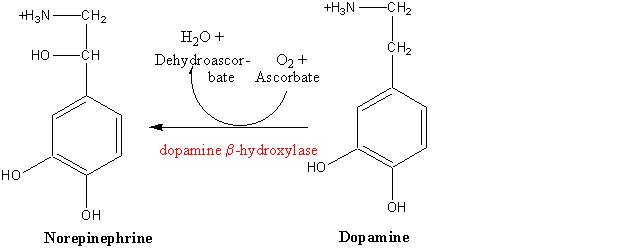
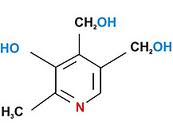
14. Пиридоксиновые коферменты. Строение ПФ, примеры реакций. Витамин B6 — собирательное название производных 3-гидрокси-2-метилпиридинов, обладающих биологической активностью пиридоксина — собственно пиридоксин, пиридоксаль, пиридоксамин, а также их фосфаты, среди которых наиболее важен пиридоксальфосфат. Различные формы в организме человека превращаются в пиридоксальфосфат — кофактор ферментов, которые катализируют декарбоксилирование и трансаминирование аминокислот. Участвует во многих аспектах метаболизма макроэлементов, синтезе нейротрансмиттеров (серотонина, дофамина, адреналина, норадреналина, ГАМК), гистамина, синтезе и функции гемоглобина, липидном синтезе, глюконеогенезе, экспрессии генов.
Пиридоксол Пиридоксальфосфат 1. Кофермент аминотрансфераз аминокислот
2. Кофермент декарбоксилаз аминокислот
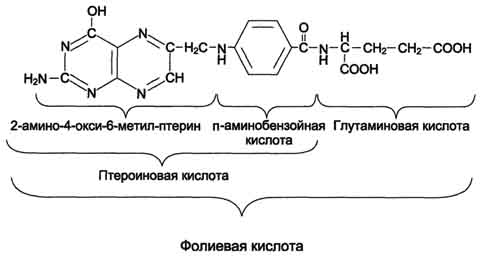
15. Роль фолиевой кислоты и В12 в реакциях трансметилирования, S-аденозилметионин, его образование. Пример реакции с цчастием фолиевой кислоты и В12.
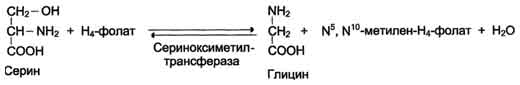
В превращениях серина и глицина главную роль играют ферменты, коферментами которых служат производные фолиевой кислоты. Молекула фолиевой кислоты (фолата) состоит из 3 частей: птеринового производного, парааминобензойной и глутаминовой кислот.
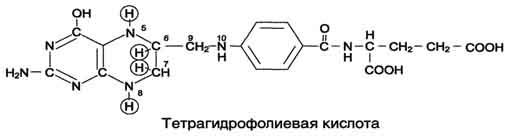
Фолиевую кислоту (фолат) называют также птероилглутаминовой кислотой. Птерины широко распространены в природе. Коферментную функцию выполняет восстановленная форма фолата - тетрагидрофолиевая кислота (ТГФК или Н4-фолат).
Фолиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH. Н4-фолат - акцептор β-углеродного атома серина. При этом образуется метиленовый мостик между атомами азота в молекуле Н4-фолата в положениях 5 и 10, образуя метилен-Н4-фолат
Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH).
Катаболизм гистидина происходит только в печени (очень небольшой процент в коже) в результате следующих реакций. Конечными продуктами катаболизма гистидина являются глутамат, NH3 и одноуглеродные фрагменты - формимино-Н4-фолат и формил-Н4-фолат. Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метионина, синтезе различных Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени.
Гомоцистеин может снова превращаться в метионин под действием гомоцистеинметилтранс феразы. Донором метильной группы в этом случае служит N5-метил-Н4-фолат: Промежуточным переносчиком метильной группы в этой реакции служит производное витамина В12 - метилкобаламин, выполняющий роль кофермента. Метионин - незаменимая аминокислота, однако может регенерироваться из гомоцистеина. Следовательно, незаменим именно гомоцистеин, но единственным его источником в организме служит метионин. Первичным донором одноуглеродныхкфраг-ментов является серин. Образовавшийся N5,N10-метилен-Н4-фолат восстанавливается до N5-метил-Н4-фолата, передающего метильную группу на кобаламин (витамин В12). Метилкобаламин непосредственно участвует в регенерации метионина. Гомоцистеин может использоваться также для синтеза цистеина. Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции.
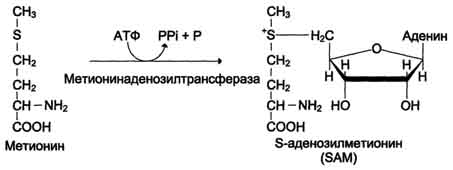
Метильная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение. Метильная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредственным донором этого одноутлеродного фрагмента служит активная форма аминокислоты. Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ.
Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT). 16. Свойства ферментов. Лабильность конформации, влияние температуры и pH среды. Специфичность действия ферментов, примеры реакций. Свойства ферментов 1.Высокая каталитическая активность. Каталитические реакции протекают в 2.Термолабильность – зависимость активности от изменения температуры. скорость р-ии
0 10 20 30 40 50 60 температура При повышении температуры на каждые 10 градусов, скорость ферментативных реакций повышает в 1,5-2 раза (правило ВАНТ - ГОФФА). Это правило применимо для ферментов в очень узком интервале температуры, т.к. уже при 50-60 градусах наблюдается денатурация, а при 100 гр. - полная денатурация с потерей активности. При 1-3ºС активность фермента также понижается, но при понижении температуры структура его сохраняется, поэтому при последующем повышении температуры активность восстанавливается. Это свойство используется в клинической практике при проведении оперативных вмешательств. Температура, при которой фермент проявляет максимальную активность, называется Оптимальной. 3. Ферменты чувствительны к изменениям РН среды. Для большинства ферментов оптимальные значения РН лежат в нейтральной среде (для трипсин РН=7). Есть ферменты, для которых оптимальные значения РН лежат в кислой среде (пепсин РН=1,5-2,5). Некоторые ферменты проявляют активность в щелочной среде (фосфатаза РН=10-11). Изменения РН приводит к изменению степени ионизации кислых и основных групп в активном центре фермента, т.к. эти группы участвуют в связывании субстрата и его превращении. Изменение РН приводит к конформационной перестройке не только активного центра фермента, но и всей молекулы фермента. Это может сопровождаться нарушением третичной структуры фермента. При оптимальном значении РН функциональные группы активного центра находятся в наиболее реакционно-способном состоянии, и это обеспечивает образование фермент-субстратного комплекса. скорость р-ии
0 1 2 3 4 5 6 7 8 9 10 11 12 pH Пепсин Трипсин Фосфатаза
4.Специфичность действия ферментов. В основе специфичности действия ферментов лежит конформационное соответствие его активного центра молекуле субстрата. Субстратная специфичность - фермент действует на 1 или несколько субстратов близких по структуре. Виды: А). Абсолютная специфичность. Ей обладают ферменты, которые действуют только на 1 субстрат и не действуют на другие субстраты. -УРЕАЗА ГИДРОЛИЗУЕТ МОЧЕВИНУЮ. -АРГИНАЗА ОТЩЕПЛЯЕТ АРГ. -ФУМАРАЗА - ГИДРАТАЦИЯ ФУМАРОВОЙ КИСЛОТЫ. В). Стереоспецифичность. Ей обладают ферменты, действующие на пространственные или стереоизомеры. ЦИС и ТРАНС изомеры; оптические изомеры (энантиомеры): к D-сахаридам, к α-аминокислотам и т.д Глюкоза под действием гексокиназы и АТФ→ глюкозо-6-фосфат + АДФ С). Групповая специфичность (относительная). Ей обладают ферменты, которые катализируют однотипные реакции сходных по строению субстратов, т.е. эти субстраты могут содержать в своём составе одинаковые группы атомов. Пример: Липаза - участвует в расщеплении липидов, содержащих в своём составе сложноэфирную связь. Каталитическая специфичность – катализация превращения субстрата по одному из возможных путей превращения т.е. разные субстраты, но одна реакция. 5.Зависимость действия от ингибиторов и активаторов. Активаторы – вещества, которые ускоряют ферментативную реакцию, А Ингибиторы её уменьшают. Лабильность конформации - способность к изменениям нативной конформации. Каталитическая активность зависит от конформации, из-за разрыва слабых связей происходит изменение конформации активного центра.
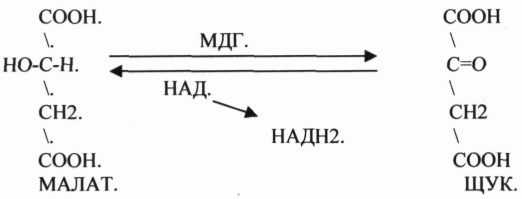
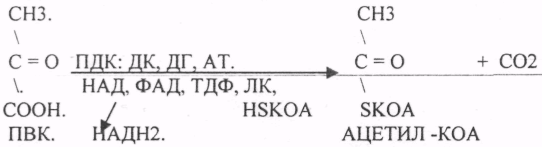
17. Номенклатура и классификация ферментов. Характеристика класса оксидоредуктаз, примеры реакций. Номенклатура 1.Тривиальная номенклатура. Например: пепсин, трипсин. 2.Рабочая номенклатура: название субстрата + тип реакции + окончание «аза».Например: ЛактатДегидрогенАза. 3.Научное название. Четырехзначное обозначение: 1-класс, 2-подкласс, 3-подподкласс, 4-порядковый номер. Например: 1.1.1.38 – эльмалат НАД-оксидоредуктаза. Классификация Ферменты делятся на 6 классов, в зависимости от типа катализируемой реакции. Класс состоит из подклассов, они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на подподклассы, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента, он может указывать на химическую природу акцептора. 6 классов: 1. Оксидоредуктазы – катализируют О-В реакции с транспортом электронов и протонов с субстрата-донора на субстрат-акцептор. 2. Трансферазы – катализируют реакции транспорта функциональных групп атомов с субстрата-донора на субстрат-акцептор. 3. Гидролазы – катализируют реакции расщепления молекул субстрата на более простые вещества с присоединением воды по месту разрыва связи. 4. Лиазы - катализируют реакции отщепления определенных групп от субстрата негидролитическим путем или присоединяют воду в месте разрыва двойной связи. 5. Изомеразы - катализируют реакции различных внутримолекулярных превращений, когда вещество переходит в свой изомер. 6. Лигазы - катализируют реакции присоединения друг к другу нескольких молекул с образованием сложного вещества – реакции синтеза. (АТФ) Класс оксидоредуктаз Ферменты этого класса участвуют в ОВР (окислительно-восстановительные реакции), т.е. в реакциях транспорта электронов и протонов. Это наиболее многочисленный класс ферментов: насчитывается более 400 оксидоредуктаз. Здесь выделяют 17 подклассов. 1. Дегидрогеназы -участвуют в реакциях дегидрирования, при этом они отнимают атомы Н2 от окисленного субстрата и переносят электроны. Акцепторы: НАД, НАДФ, ФАД, ФМН. Подподклассы: 1. НАД-зависимые дегидрогеназы
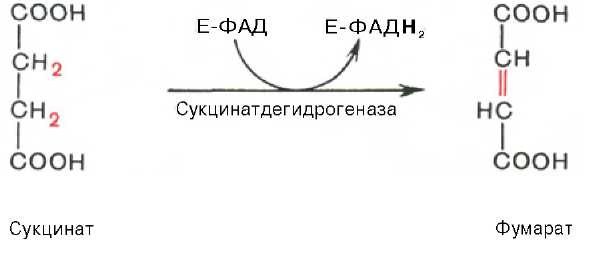
2.ФАД-зависимые дегидрогеназы
2. Редуктазы – катализируют реакции восстановления субстрата донором протонов – коферментом НАДФН2.
3. Оксидазы -катализируют реакции в которых акцептором выступает молекулярный кислород. О2 +4 4. Оксигеназы -катализируют реакции присоединения кислорода к субстрату с образованием гидроксильной группы.
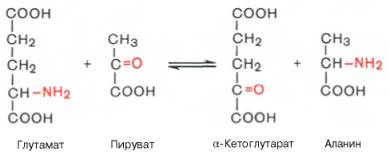
5. Пероксидазы -катализируют реакции разрушения пероксидов. 2Н2О2 каталаза 2Н2О + О2 6. Цитохромы -катализируют реакции транспорта только электронов т.о. они участвуют в процессе тканевого дыхания. Характеристика класса трансфераз и гидролаз. Примеры реакций. Трансферазы- это ферменты транспортирующие группы атомов с одного субстрата-донора на другой субстрат-акцептор. В зависимости от химической природы выделяют подклассы: 1.Аминотрансферазы катализируют реакции переноса NH2 с аминокислоты на α-кетоглутарат, в результате образуется новая аминокислота и кетокислота. Коферемент В6 –ПФ. АлАт, АсАт – диагностическое значение.
2.Метилтрансферазы ферменты класса трансфераз, катализирующие обратимые реакции переноса метильных групп. Донором СН3-групп служит преимущественно метионин, который вместе с производными витамина B12 и фолиевой кислоты образует систему переметилирования у всех видов живых организмов.
3.Гликозилтрансферазы - группа ферментов класса трансфераз, катализирующих перенос гликозильных групп на орто- и пирофосфорную к-ты, олиго- и полисахариды, Н2О или др. акцептор. Делятся на гексозил- и пентозилтрансферазы. Обладают строгой субстратной специфичностью по отношению к донору углевода и к конфигурации синтезируемой связи. К гликозилтрансферазам, переносящим гликозильную группу только на Н3РО4 (т. наз. истинные фосфорилазы), относится, напр., гликогенфосфорилаза, расщепляющая гликоген с образованием глюкозо-1-фосфата:
4.Фосфотрансферазы - группа ферментов класса трансфер
|
||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 915; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.139.164 (0.018 с.) |









 -
-  раз быстрее, чем некаталитические. 1 молекула фермента за 1сек трансформирует от 100 до 1000 молекул субстрата в продукт.
раз быстрее, чем некаталитические. 1 молекула фермента за 1сек трансформирует от 100 до 1000 молекул субстрата в продукт.
 +4е цитохромоксидаза 2Н2О
+4е цитохромоксидаза 2Н2О