
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
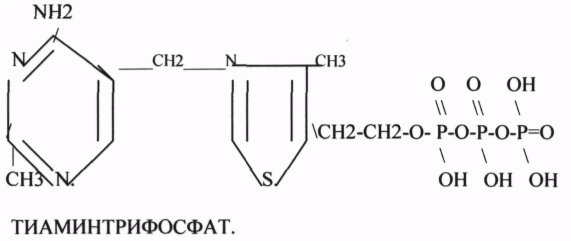
Предшественник – витамин В1- тиамин.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
A. ТМФ - ТИАМИНМОНОФОСФАТ. Б. ТДФ или ТПФ - ТИАМИНДИФОСФАТ или ТИАМИНПИРОФОСФАТ B. ТТФ - ТИАМИНТРИФОСФАТ. ТПФ связана с ферментами ДЕКАРБОКСИЛАЗАМИ альфа КЕТОКИСЛОТ (ПВК, альфа КГК), кофермент транскетолазы.
Реакции с участием ТДФ:
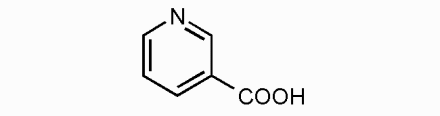
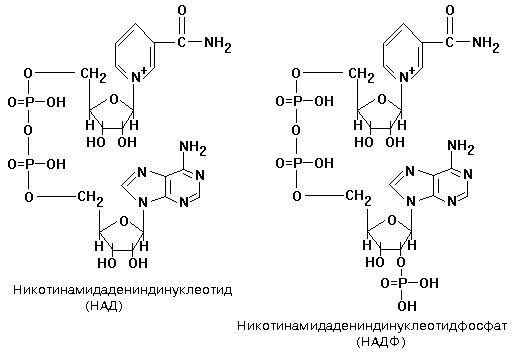
1. 2. Никотинамидные коферменты. Структура НАД, НАДФ. Примеры реакций. Никотинамидные коферменты - коферментные формы никотиновой кислоты (витамина PP). Включают НАД (никотинамидадениндинуклеотид), НАДФ (никотинамидадениндинуклеотидфосфат), НАДН (восстановленный НАД), НАДФН (восстановленный НАДФ). Никотинамидные коферменты - коферменты дегидрогеназ - промежуточные акцепторы и переносчики электронов и водорода.
Никотиновая кислота 1.Кофермент дегидрогеназ
2. Компонент дыхательной цепи
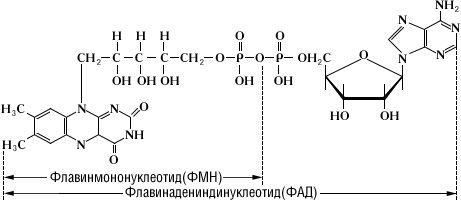
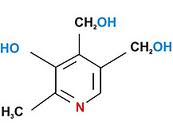
Флавиновые коферменты. Структура ФМН,ФАД. Примеры реакций. Флавиновые коферменты ФМН (FMN) и ФАД (FAD) найдены в дегидрогеназах, оксидазах и монооксигеназах. Обычно оба соединения ковалентно связаны с ферментами. Активной группой обоих коферментов является флавин (изоаллоксазин), имеющий сопряженную систему из трех колец, которая может при восстановлении принимать два электрона и два протона. Предшественник – витамин В2 – рибофлавин. ФАД состоит из ФМН, связанного с АМФ. Оба соединения являются функционально близкими коферментами.
Рибофлавин 1.Кофермент дегидрогеназ
2.Компонент дыхательной цепи
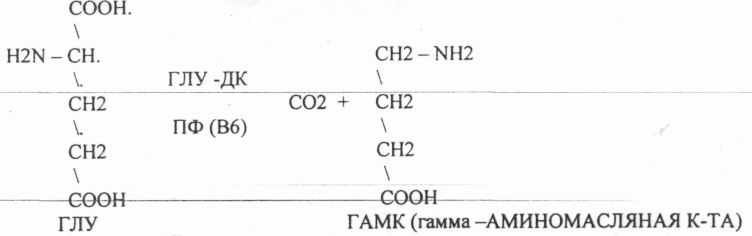
14. Пиридоксиновые коферменты. Строение ПФ, примеры реакций. Витамин B6 — собирательное название производных 3-гидрокси-2-метилпиридинов, обладающих биологической активностью пиридоксина — собственно пиридоксин, пиридоксаль, пиридоксамин, а также их фосфаты, среди которых наиболее важен пиридоксальфосфат. Различные формы в организме человека превращаются в пиридоксальфосфат — кофактор ферментов, которые катализируют декарбоксилирование и трансаминирование аминокислот. Участвует во многих аспектах метаболизма макроэлементов, синтезе нейротрансмиттеров (серотонина, дофамина, адреналина, норадреналина, ГАМК), гистамина, синтезе и функции гемоглобина, липидном синтезе, глюконеогенезе, экспрессии генов.
Пиридоксол Пиридоксальфосфат 1. Кофермент аминотрансфераз аминокислот
2. Кофермент декарбоксилаз аминокислот
15. Роль фолиевой кислоты и В12 в реакциях трансметилирования, S-аденозилметионин, его образование. Пример реакции с цчастием фолиевой кислоты и В12.
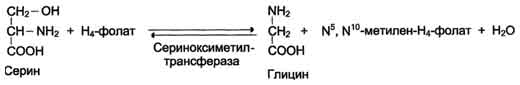
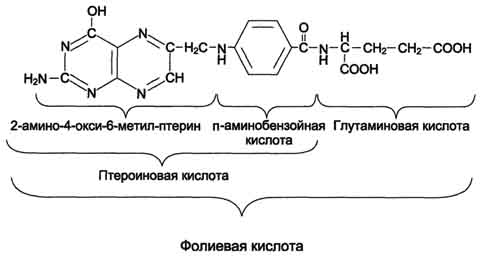
В превращениях серина и глицина главную роль играют ферменты, коферментами которых служат производные фолиевой кислоты. Молекула фолиевой кислоты (фолата) состоит из 3 частей: птеринового производного, парааминобензойной и глутаминовой кислот.
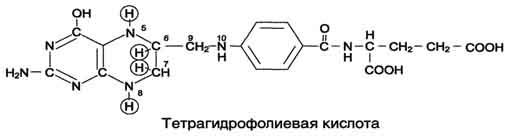
Фолиевую кислоту (фолат) называют также птероилглутаминовой кислотой. Птерины широко распространены в природе. Коферментную функцию выполняет восстановленная форма фолата - тетрагидрофолиевая кислота (ТГФК или Н4-фолат).
Фолиевая кислота в печени превращается в Н4-фолат в несколько стадий с участием ферментов фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит NADPH. Н4-фолат - акцептор β-углеродного атома серина. При этом образуется метиленовый мостик между атомами азота в молекуле Н4-фолата в положениях 5 и 10, образуя метилен-Н4-фолат
Особое значение реакций катаболизма серина и глицина заключается в том, что они сопровождаются образованием одноуглеродного метиленового фрагмента (-СН2-). Метиленовая группа в молекуле метилен- Н4-фолата может превращаться в другие одноуглеродные группы (фрагменты): метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH).
Катаболизм гистидина происходит только в печени (очень небольшой процент в коже) в результате следующих реакций. Конечными продуктами катаболизма гистидина являются глутамат, NH3 и одноуглеродные фрагменты - формимино-Н4-фолат и формил-Н4-фолат. Все образующиеся производные Н4-фолата играют роль промежуточных переносчиков и служат донорами одноуглеродных фрагментов при синтезе некоторых соединений: пуриновых оснований и тимидиловой кислоты (необходимых для синтеза ДНК и РНК), регенерации метионина, синтезе различных Перенос одноуглеродных фрагментов к акцептору необходим не только для синтеза ряда соединений, но и для регенерации свободного Н4-фолата в печени.
Гомоцистеин может снова превращаться в метионин под действием гомоцистеинметилтранс феразы. Донором метильной группы в этом случае служит N5-метил-Н4-фолат: Промежуточным переносчиком метильной группы в этой реакции служит производное витамина В12 - метилкобаламин, выполняющий роль кофермента. Метионин - незаменимая аминокислота, однако может регенерироваться из гомоцистеина. Следовательно, незаменим именно гомоцистеин, но единственным его источником в организме служит метионин. Первичным донором одноуглеродныхкфраг-ментов является серин. Образовавшийся N5,N10-метилен-Н4-фолат восстанавливается до N5-метил-Н4-фолата, передающего метильную группу на кобаламин (витамин В12). Метилкобаламин непосредственно участвует в регенерации метионина. Гомоцистеин может использоваться также для синтеза цистеина. Метионин - незаменимая аминокислота. Она необходима для синтеза белков организма, участвует в реакциях дезаминирования, является источником атома серы для синтеза цистеина. Метионил-тРНК участвует в инициации процесса трансляции.
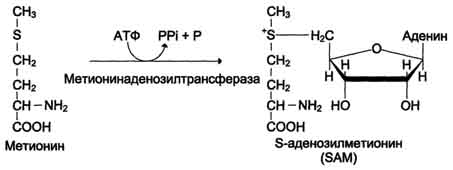
Метильная группа метионина - мобильный одноуглеродный фрагмент, используемый для синтеза ряда соединений. Перенос метильной группы метионина на соответствующий акцептор называют реакцией трансметилирования, имеющей важное метаболическое значение. Метильная группа в молекуле метионина прочно связана с атомом серы, поэтому непосредственным донором этого одноутлеродного фрагмента служит активная форма аминокислоты. Активной формой метионина является S-аденозилметионин (SAM) - сульфониевая форма аминокислоты, образующаяся в результате присоединения метионина к молекуле аденозина. Аденозин образуется при гидролизе АТФ.
Эту реакцию катализирует фермент метионин аденозилтрансфераза, присутствующий во всех типах клеток. Структура (-S+-CH3) в SAM - нестабильная группировка, определяющая высокую активность метильной группы (отсюда термин "активный метионин"). Эта реакция уникальна для биологических систем, так как, по-видимому, является единственной известной реакцией, в результате которой освобождаются все три фосфатных остатка АТФ. Отщепление метильной группы от SAM и перенос её на соединение-акцептор катализируют ферменты метилтрансферазы. SAM в ходе реакции превращается в S-аденозилгомоцистеин (SAT). 16. Свойства ферментов. Лабильность конформации, влияние температуры и pH среды. Специфичность действия ферментов, примеры реакций. Свойства ферментов 1.Высокая каталитическая активность. Каталитические реакции протекают в 2.Термолабильность – зависимость активности от изменения температуры. скорость р-ии
0 10 20 30 40 50 60 температура При повышении температуры на каждые 10 градусов, скорость ферментативных реакций повышает в 1,5-2 раза (правило ВАНТ - ГОФФА). Это правило применимо для ферментов в очень узком интервале температуры, т.к. уже при 50-60 градусах наблюдается денатурация, а при 100 гр. - полная денатурация с потерей активности. При 1-3ºС активность фермента также понижается, но при понижении температуры структура его сохраняется, поэтому при последующем повышении температуры активность восстанавливается. Это свойство используется в клинической практике при проведении оперативных вмешательств. Температура, при которой фермент проявляет максимальную активность, называется Оптимальной. 3. Ферменты чувствительны к изменениям РН среды. Для большинства ферментов оптимальные значения РН лежат в нейтральной среде (для трипсин РН=7). Есть ферменты, для которых оптимальные значения РН лежат в кислой среде (пепсин РН=1,5-2,5). Некоторые ферменты проявляют активность в щелочной среде (фосфатаза РН=10-11). Изменения РН приводит к изменению степени ионизации кислых и основных групп в активном центре фермента, т.к. эти группы участвуют в связывании субстрата и его превращении. Изменение РН приводит к конформационной перестройке не только активного центра фермента, но и всей молекулы фермента. Это может сопровождаться нарушением третичной структуры фермента. При оптимальном значении РН функциональные группы активного центра находятся в наиболее реакционно-способном состоянии, и это обеспечивает образование фермент-субстратного комплекса. скорость р-ии
0 1 2 3 4 5 6 7 8 9 10 11 12 pH Пепсин Трипсин Фосфатаза
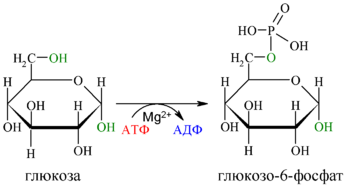
4.Специфичность действия ферментов. В основе специфичности действия ферментов лежит конформационное соответствие его активного центра молекуле субстрата. Субстратная специфичность - фермент действует на 1 или несколько субстратов близких по структуре. Виды: А). Абсолютная специфичность. Ей обладают ферменты, которые действуют только на 1 субстрат и не действуют на другие субстраты. -УРЕАЗА ГИДРОЛИЗУЕТ МОЧЕВИНУЮ. -АРГИНАЗА ОТЩЕПЛЯЕТ АРГ. -ФУМАРАЗА - ГИДРАТАЦИЯ ФУМАРОВОЙ КИСЛОТЫ. В). Стереоспецифичность. Ей обладают ферменты, действующие на пространственные или стереоизомеры. ЦИС и ТРАНС изомеры; оптические изомеры (энантиомеры): к D-сахаридам, к α-аминокислотам и т.д Глюкоза под действием гексокиназы и АТФ→ глюкозо-6-фосфат + АДФ С). Групповая специфичность (относительная). Ей обладают ферменты, которые катализируют однотипные реакции сходных по строению субстратов, т.е. эти субстраты могут содержать в своём составе одинаковые группы атомов. Пример: Липаза - участвует в расщеплении липидов, содержащих в своём составе сложноэфирную связь. Каталитическая специфичность – катализация превращения субстрата по одному из возможных путей превращения т.е. разные субстраты, но одна реакция. 5.Зависимость действия от ингибиторов и активаторов. Активаторы – вещества, которые ускоряют ферментативную реакцию, А Ингибиторы её уменьшают. Лабильность конформации - способность к изменениям нативной конформации. Каталитическая активность зависит от конформации, из-за разрыва слабых связей происходит изменение конформации активного центра.
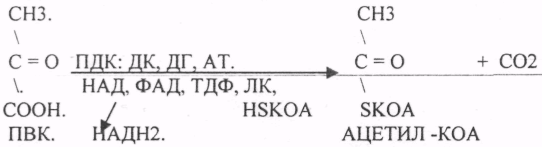
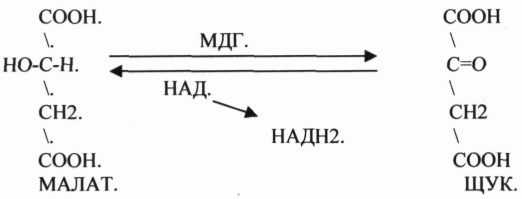
17. Номенклатура и классификация ферментов. Характеристика класса оксидоредуктаз, примеры реакций. Номенклатура 1.Тривиальная номенклатура. Например: пепсин, трипсин. 2.Рабочая номенклатура: название субстрата + тип реакции + окончание «аза».Например: ЛактатДегидрогенАза. 3.Научное название. Четырехзначное обозначение: 1-класс, 2-подкласс, 3-подподкласс, 4-порядковый номер. Например: 1.1.1.38 – эльмалат НАД-оксидоредуктаза. Классификация Ферменты делятся на 6 классов, в зависимости от типа катализируемой реакции. Класс состоит из подклассов, они уточняют действие ферментов и указывают на химическую природу группы, которую атакует фермент. Подклассы делятся на подподклассы, которые ещё более конкретизируют действие ферментов, указывают на связь в молекуле субстрата, которая подвергается действию фермента, он может указывать на химическую природу акцептора. 6 классов: 1. Оксидоредуктазы – катализируют О-В реакции с транспортом электронов и протонов с субстрата-донора на субстрат-акцептор. 2. Трансферазы – катализируют реакции транспорта функциональных групп атомов с субстрата-донора на субстрат-акцептор. 3. Гидролазы – катализируют реакции расщепления молекул субстрата на более простые вещества с присоединением воды по месту разрыва связи. 4. Лиазы - катализируют реакции отщепления определенных групп от субстрата негидролитическим путем или присоединяют воду в месте разрыва двойной связи. 5. Изомеразы - катализируют реакции различных внутримолекулярных превращений, когда вещество переходит в свой изомер. 6. Лигазы - катализируют реакции присоединения друг к другу нескольких молекул с образованием сложного вещества – реакции синтеза. (АТФ) Класс оксидоредуктаз Ферменты этого класса участвуют в ОВР (окислительно-восстановительные реакции), т.е. в реакциях транспорта электронов и протонов. Это наиболее многочисленный класс ферментов: насчитывается более 400 оксидоредуктаз. Здесь выделяют 17 подклассов. 1. Дегидрогеназы -участвуют в реакциях дегидрирования, при этом они отнимают атомы Н2 от окисленного субстрата и переносят электроны. Акцепторы: НАД, НАДФ, ФАД, ФМН. Подподклассы: 1. НАД-зависимые дегидрогеназы
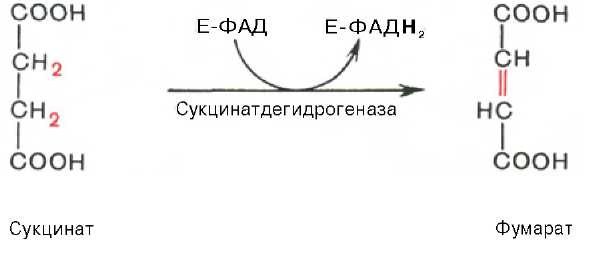
2.ФАД-зависимые дегидрогеназы
2. Редуктазы – катализируют реакции восстановления субстрата донором протонов – коферментом НАДФН2.
3. Оксидазы -катализируют реакции в которых акцептором выступает молекулярный кислород. О2 +4 4. Оксигеназы -катализируют реакции присоединения кислорода к субстрату с образованием гидроксильной группы.
5. Пероксидазы -катализируют реакции разрушения пероксидов. 2Н2О2 каталаза 2Н2О + О2 6. Цитохромы -катализируют реакции транспорта только электронов т.о. они участвуют в процессе тканевого дыхания. Характеристика класса трансфераз и гидролаз. Примеры реакций. Трансферазы- это ферменты транспортирующие группы атомов с одного субстрата-донора на другой субстрат-акцептор. В зависимости от химической природы выделяют подклассы: 1.Аминотрансферазы катализируют реакции переноса NH2 с аминокислоты на α-кетоглутарат, в результате образуется новая аминокислота и кетокислота. Коферемент В6 –ПФ. АлАт, АсАт – диагностическое значение.
2.Метилтрансферазы ферменты класса трансфераз, катализирующие обратимые реакции переноса метильных групп. Донором СН3-групп служит преимущественно метионин, который вместе с производными витамина B12 и фолиевой кислоты образует систему переметилирования у всех видов живых организмов.
3.Гликозилтрансферазы - группа ферментов класса трансфераз, катализирующих перенос гликозильных групп на орто- и пирофосфорную к-ты, олиго- и полисахариды, Н2О или др. акцептор. Делятся на гексозил- и пентозилтрансферазы. Обладают строгой субстратной специфичностью по отношению к донору углевода и к конфигурации синтезируемой связи. К гликозилтрансферазам, переносящим гликозильную группу только на Н3РО4 (т. наз. истинные фосфорилазы), относится, напр., гликогенфосфорилаза, расщепляющая гликоген с образованием глюкозо-1-фосфата:
4.Фосфотрансферазы - группа ферментов класса трансфераз. Катализируют в живых клетках реакции переноса свободного или замещенного фосфата. Фосфокиназа.
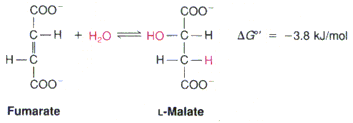
19.Лиазы, изомеразы, лигазы. Характеристика, примеры реакций с участием ферментов этих классов. Лиазы – ферменты, которые отщепляют определенные группы от субстрата негидролитическим путем или присоединяют воду по месту разрыва двойной связи.
Фумараза
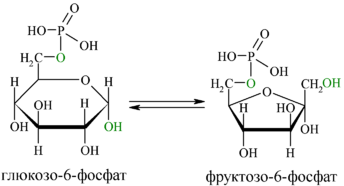
Изомеразы – ферменты, катализирующие различные внутримолекулярные превращения, когда вещество переходит в свой изомер. Глю-6-фосфатизомераза
Если изомеризация заключается во внутримолекулярном переносе атома из одного положения в другое, то фемент называют мутазой, например, получение глюкозо-1-фосфата из глю-6-фосфата. Лигазы (синтетазы) – катализируют реакции приссоединения друг к другу нескольких молекул с образованием более сложного вещества. Для этих реакций необходима энергия, если донор – АТФ, то фермент – синтетаза. Если донор другое макроэргическое соединение, то фермент – синтаза.
20. Современные представления о механизме действия ферментов. Стадии ферментативного катализа, молекулярные эффекты, примеры. С термодинамической точки зрения, действие любого фермента направлено на понижение энергии активации. Энергия активации - это то дополнительное количество энергии, которое нужно сообщить молекуле, чтобы перевести её из неактивного состояния в состояние активности. Чем ниже энергия активации, тем выше скорость реакции. 70 лет назад была предложена теория Михаэлиса и Ментенома. Они выдвинули понятие о F-S комплексе. Фермент взаимодействует с субстратом, образуя нестойкий промежуточный F-S комплекс, который затем распадается с образованием продуктов реакции (Р) и освобождением фермента. В этом процессе выделяют несколько стадий: 1.Диффузия субстрата к ферменту и их стерическое взаимодействие с образованием F-S комплекса. E+S=ES. Эффект концентрации молекул субстрата в области активного центра фермента. Уменьшается расстояние между субстратом и активным центром, что увеличивает скорость взаимодействия.
Эффект ориентации – в процессе сближения фермент и субстрат ориентируются друг к другу теми функциональными группами, которые принимают участиев катализе. Это возможно благодаря вращательным движениям фермента субстрата.
Эффект индуцированного соответствия – характерен для ферментов обладающих свойством групповой специфичности. Субстрат, взаимодействуя с активным центром фермента вызывает изменение его конформации на благоприятную для химического превращения субстрата.
Эта стадия не продолжительна. Её скорость зависит от концентрации субстрата и скорости диффузии его к активному центру фермента. На этой стадии практически не происходит понижения энергии активации.
2.Преобразование F-S комплекса в один, или несколько, активированных комплексов, при этом происходит расслабление и разрыв старых химических связей в молекуле субстрата под действием каталитических групп активного центра фермента. E+S=ES*=ES** Эффект натяжения ("дыбы"). До присоединения субстрата к активному центру фермента, его молекула как бы в расслабленном состоянии. После связывания молекула субстрата растягивается и принимает напряжённую деформированную конфигурацию. При этом увеличивается длина межатомных связей, следовательно, понижается Е активации. Кислотно-основный катализ: аминокислотные остатки в составе активного цента имеют функциональные группы кислотного и основного характера. Кислотные группы в реакциях доноры, а основные – акцепторы. В результате заряженные частицы перераспределяются, разрушаются старые и образуются новые связи. Ковалентный катализ: между субстратом и активным центром фермента формируются ковалентные связи, по окончанию катализы эти связи разрушаются и продукт высвобождается, поэтому у продукта появляются новые связи. Эта стадия является наиболее продолжительной по времени. При этом происходит разрыв связей в молекуле субстрата, образование новых связей, т.е. образуются Р реакции. Е активации снижается. 3.Образование и освобождение продуктов реакции от фермента и поступление их в окружающую среду. ES**=EP=E+P. Образующиеся продукты диффундируют в окружающую среду, а активный центр освобождается. Стадия непродолжительна, снижение энергии активации незначительно.
21. Ингибирование ферментов. Конкурентное и неконкурентное ингибирование, примеры реакций. Лекарственные вещества, как ингибиторы ферментов. Ингибирование ферментов – снижение каталитической активности в присутствии ингибитора. По характеру действия ингибиторы делятся на 2 большие группы: 1.Обратимые - это соединения, которые нековалентно взаимодействуют с ферментом, при этом образуется комплекс, способный к диссоциации. 2.Необратимые - это соединения, которые могут специфически связывать определенные функциональные группы активного центра фермента. Они образуют с ним прочные ковалентные связи, поэтому такой комплекс трудно разрушить. По механизму действия выделяют следующие виды ингибирования: 1. Конкурентное - это обратимое торможение ферментативной реакции, вызванное связыванием с активным центром фермента ингибитора, который по своей структуре близок к структуре субстрата (аналог). При этом и субстрат, и ингибитор могут взаимодействовать с ферментом, но они будут конкурировать за активный центр фермента, и связываться будет то вещество, которого больше.
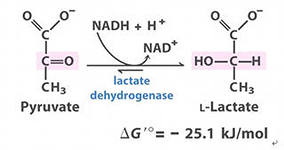
Конкурентным ингибитором данной реакции является малоновая кислота, поэтому с активным центром фермента связывается и та, и другая кислота, в зависимости от их соотношения в растворе. Чтобы снять частично или полностью действие конкурентного ингибитора, нужно повысить концентрацию субстрата. При этом весь фермент будет находиться в форме фермент-субстратного комплекса, а доля комплекса фермент-ингибитор будет резко понижаться, поэтому скорость ферментативной реакции может быть максимальной даже в присутствии ингибитора. Многие лекарственные препараты действуют по типу конкурентного ингибитора. При этом они тормозят активность ряда ферментов, необходимых для функционирования бактериальных клеток. Примером является применение сульфанила (СА). При различных инфекционных заболеваниях, которые вызываются бактериями, применяются СА препараты. Эти препараты имеют структурное сходство с парааминобензойной кислотой, которая используется бактериями для синтеза фолиевой кислоты, необходимой для роста и размножения бактерий. Введение СА приводит к ингибированию фермента бактерий, которые синтезируют фолиевую кислоту. Нарушение синтеза этой кислоты проводит к нарушению роста микроорганизмов и их гибели. По принципу конкурентных ингибиторов действует целая группа различных препаратов – это антихолинэстеразы. Они являются конкурентными ингибиторами фермента холинэстеразы, катализирующей гидролиз ацетилхолина, который обеспечивает проведение нервного импульса. Антихолинэстеразы конкурируют с ацетилхолином за активный центр фермента холинэстеразы. В результате этого распад ацетилхолина тормозится, он накапливается в организме, вызывая нарушение проведения нервного импульса. 2.Неконкурентное - это торможение ферментативной реакции, вызванное влиянием ингибитора на каталитическое превращение субстрата. При этом ингибитор не влияет на связывание фермента с субстратом. Неконкурентный ингибитор может связываться либо с каталитическими группами активного центра фермента, либо вне активного центра фермента, но при этом он изменяет конформацию фермента и затрагивает каталитический участок его активного центра. При неконкурентном, возможно образование тройного комплекса. E+S+I=ESI В качестве неконкурентного ингибитора выступают цианиды. Они прочно связываются с ионами железа, которые входят в состав каталитического геминового фермента - цитохромоксидазы. Этот фермент является одним из компонентов дыхательной цепи. Блокирование дыхательной цепи выключает её из работы, что приводит к мгновенной гибели организме. Примером неконкурентного ингибитора являются соли тяжёлых металлов. Они блокируют -SH группы, которые входят в каталитический участок фермента. При этом образуется F-I комплекс. Он способен присоединять субстрат, но дальнейшего превращения субстрата не происходит, т.к. каталитические группы фермента заблокированы. Реакция непродуктивна. Снять действие неконкурентного ингибитора очень сложно, т.к. ионы металлов очень прочно связываются с активным центром фермента. Действие этого ингибитора можно снять только с помощью специальных веществ - реактивов. 3.Субстратное - это торможение ферментативной реакции, вызванное избытком субстрата. При этом образуется F-S комплекс, но он не подвергается каталитическим превращениям, т.к. делает молекулу фермента неактивной. Действие субстратного ингибитора снимается путём уменьшения концентрации субстрата. 4.Аллостерическое характерно для ферментов, имеющих четвертичную структуру, молекула которых состоит из нескольких единиц (ПРОТОМЕРОВ). Эти ферменты могут иметь 2 и более единиц. При этом одна имеет каталитический центр и называется каталитической, а другая - аллостерический центр и называется регуляторной. В отсутствии аллостерического ингибитора субстрат присоединяется к каталитическому центру, и идёт обычная каталитическая реакция. При появлении аллостерического ингибитора, он присоединяется к регуляторной единице и изменяет конформацию центра фермента, в результате этого активность фермента снижается. 22. Понятие об изоферментах. Характеристика изоферментов Лактатдегидрогеназы (ЛДГ) и креатинкиназы (КК). Использование ферментов в медицине. Энзимодиагностика, энзимотерапия. Энзимопатология, примеры. Изоферменты - фермены, катализирующие одну реакцию, но различающиеся по первичной структуре белковой части и физико-химическим различиям. Множественные формы ферментов - это модификации одного фермента. ЛДГ (Лактатдегидрогеназа) – катализирует обратимую реакцию окисления лактата до пирувата.
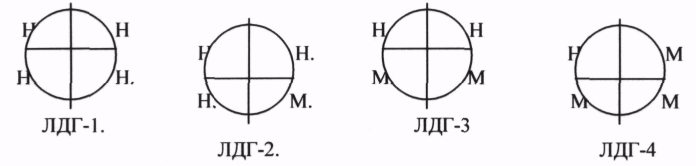
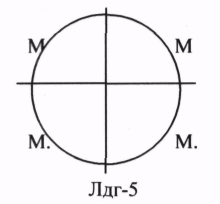
Имеет 5 изоформ, каждая из которых является тетрамером - состоит из 4 субъединиц Н-(сердце) и М-(мышца) типов. ЛДГ 1и2 наиболее активны с сердце и почках (аэробные условия), ЛДГ4и5 – в скелетных мышцах и печени (анаэробные условия). В остальных тканях имеются различные формы.
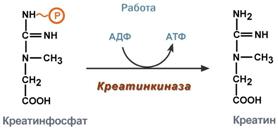
Миокард, Почки Печень, Скелетная мускулатура Внорме ЛДГ в плазме крови = 170-520 ЕД/л. Повышение – поражение тканей. Тканеспецифичность определяют с помощью электрофореза. КК (Креатинкиназа) – катализирует реакцию образования креатинфосфата.
Молекула КК – димер, состоящий из субъединиц 2х типов: М-(мышца) и В-(мозг).Из них образуется 3 изофермента: ВВ – в головном мозге, в крови практически не определяется (гематоэнцефалический барьер). МВ – в сердечной мышце, увеличение при инфаркте миокарда. ММ – в скелетных мышцах, увеличение при травмах. В норме активность КК= 90МЕ/л Ферменты в медицине Энзимодиагностика - определение активности ферментов в диагностических целях. Принципы: ü При повреждении клеток в биологических жидкостях увеличивается концентрация внутриклеточных ферментов поврежденный клеток. ü Активность ферментов в биологических жидкостях, при повреждениях клеток, длительно стабильна и отличается от нормальных показателей. ü Ряд ферментов имеет органоспецифичность. Ферменты плазмы крови делятся на ферменты секретируемые определенными органами и ферменты, высвобождающиеся из клеток во время нормального функционирования (чаще функционируют внутри клетки). Обнаружение в плазме цитозольных или ядерных ферментов говорит о повреждениях клеток. Иногда повышение концентрации ферметнов говорит об онкопролиферативных процецессах. Энзимотерапия – использование ферментов в качестве терапевтических средств.
Энзимопатологя – нарушение функционирования ферментов в клетке. Бывают первычные (наследственные) и вторичные (приобретенные). Возможные нарушения:
Ø Нарушение образования конечных продуктов, что приводит к клиническим проявлениям. Например Альбинизм – нарушение синтеза меланина → слабая пигментация кожи, светлые волосы, красноватый цвет радужки – недостаточность тирозиназы. Ø Накопление субстратов-предшественников. Накопление алкаптона – нарушение подвижности суставов.
|
||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 1359; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.238.204 (0.017 с.) |








 -
-  раз быстрее, чем некаталитические. 1 молекула фермента за 1сек трансформирует от 100 до 1000 молекул субстрата в продукт.
раз быстрее, чем некаталитические. 1 молекула фермента за 1сек трансформирует от 100 до 1000 молекул субстрата в продукт.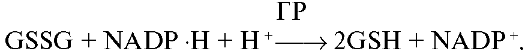
 +4е цитохромоксидаза 2Н2О
+4е цитохромоксидаза 2Н2О



 Заместительная терапия использование ферментов при их недостаточности. Например при ахилии, гипо и анацидных гастритах испльзуют пепсин.
Заместительная терапия использование ферментов при их недостаточности. Например при ахилии, гипо и анацидных гастритах испльзуют пепсин.


