Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ферменты, их химическая природа, структурная организация. Активный центр ферментов, его свойства.
Ферменты - это биологические катализаторы белковой природы. Роль ферментов в организме огромна. В каждой клетке организма находится до 10000 молекул ферментов, которые катализируют более 2000 различных химических реакций. Энзимология - раздел науки, изучающий ферменты. ОБЩИЕ ЧЕРТЫ ФЕРМЕНТОВ И НЕБИОЛОГИЧЕСКИХ КАТАЛИЗАТОРОВ. 1. Повышают скорость реакции. 2. В реакциях они не расходуются. 3. Для обратимых процессов и прямая, и обратная реакция катализируется одним и тем же ферментом. ОТЛИЧИТЕЛЬНЫЕ ПРИЗНАКИ ФЕРМЕНТОВ. 1.Ферменты обладают более высокой эффективностью действия (повышают скорость реакции в большее число раз, чем неорганические КАТ). УРЕАЗА (гидролиз мочевины) повышает скорость реакции в 10 раз. 2.Ферменты чувствительны к температуре (ТЕРМОЛАБИЛЬНЫ) 3.Ферменты чувствительны к значениям РН среды. 4.Ферменты, в отличие от неорганических КАТ, обладают высокой специфичностью действия. 5.Ферменты - это катализаторы с регулируемой активностью. Ферменты, являясь белками, повторяют все особенности структуры и состава белков (состоят из АК, имеют 4 уровня структурной организации), физико-химические свойства белков. Ферменты, как и все функциональные белки, могут быть простыми и сложными. Простые ферменты представлены только белковой частью (состоят из АК) - ПЕПСИН, ТРИПСИН, ФОСФАТАЗЫ. В структурном отношении имеют 3 уровня организации (ГЛОБУЛА). Сложные ферменты представлены: 1.Белковой частью (состоит из АК) - Апофермент; 2.Небелковой частью - Кофактор. Выделяют 2 основных КОФАКТОРА: А. Ионы металлов (К, Na, Ca, Mg, Mn) большинство всех ферментов являются МЕТАЛЛОФЕРМЕНТАМИ. В продуктах питания должны обязательно содержаться микроэлементы. В. Коферменты - низкомолекулярные органические вещества не белковой природы. Для многих ферментов его апофермент вместе с кофактором образуют каталитически активную молекулу, которая называется холоферментом. АПОФЕРМЕНТ+КОФАКТОР=ХОЛОФЕРМЕНТ. СТРОЕНИЕ ФЕРМЕНТОВ. В пространственной структуре фермента можно выделить отдельные участки, которые выполняют те или иные функции (активный центр, контактный участок, каталитический участок, АЛЛОСТЕРИЧЕСКИЙ центр). Активный центр - это участок в молекуле фермента, где происходит связывание и превращение субстрата. Он обычно располагается в гидрофобном углублении (недоступном для молекул воды), изолируя субстрат от воды. В образовании активного центра участвуют боковые группы АК, причём эти АК могут находиться на разных участках полипептидной цепи, но при формировании пространственной конфигурации фермента они укладываются т.о., что располагаются в области активного центра. В образовании активного центра принимают участие следующие группы боковых цепей АК:
- NH2 (АРГ,ЛИЗ) - СООН (АСП, ГЛУ) - SH (ЦИС) - ОН (СЕР,ТРЕ) - ИМИДАЗОЛ (ГИС) - ГУАНИДИНО группа Фенольное кольцо (ТИР) Остальные АК поддерживают пространственную конфигурацию активного центра фермента и обеспечивают его реакционную способность. Контактный участок (субстратная площадка) - это место в активном центре фермента, где происходит связывание субстрата с его активным центром. Контактный участок обеспечивает специфическое сродство субстрата к ферменту. Каталитический участок – место в активном центре, где проходит сама каталитическая реакция. Аллостерический (регуляторный) центр - участок в молекуле фермента, расположенный вне активного центра. К аллостерическому центру могут присоединяться различные вещества, которые отличаются по структуре от молекул субстрата – регуляторы (аллостерические эффекторы). Они могут влиять на конформацию активного центра фермента. В роли регуляторов чаще всего выступают гормоны, лекарственные вещества и др. химические соединения.
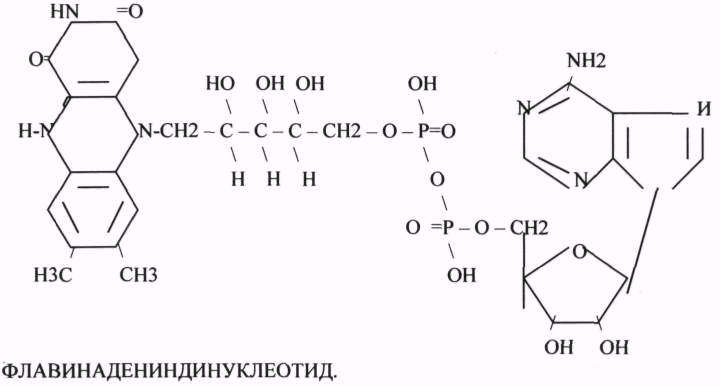
Коферменты и их функции в ферментативных реакциях. Витаминные коферменты. Примеры реакций с участием витаминных коферментов. Тиаминовые коферменты, ТДФ. Коферменты - низкомолекулярные органические вещества не белковой природы. Коферменты являются или акцепторами, или донорами различных атомов, или даже атомных групп. Они чаще всего содержат в своём составе различные витамины, следовательно, их делят на две группы: 1.Витаминные. 2.Невитаминные. Витаминные коферменты: Флавиновые коферменты содержат в своём составе витамин В 2. 1.ФМН - ФЛАВИНМОНОНУКЛЕОТИД. 2.ФАД - ФЛАВИИАДЕНИНДИНУКЛЕОТИД. ФАД*Н2
ФМН и ФАД связанны с ферментами ДЕГИДРОГЕНАЗАМИ. Участвуют в реакциях ДЕГИДРИРОВАНИЯ. Пантотеиновые коферменты содержат в своём составе витамин ВЗ (ПАНТОТЕИНОВАЯ К-ТА). KO-F A (HSK.O-A - HS КОЭНЗИМ А). КОФЕРМЕНТ АЦИЛИРОВАНИЯ. Никотинамидные коферменты содержат в своём составе витамин РР (НИАЦИН). 1.НАД (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИД). 2.НАДФ (НИКОТИНАМИДАДЕНИНДИНУКЛЕОТИДФОСФАТ).
НАД и НАДФ также связаны с ферментами ДЕГИДРОГЕНАЗАМИ, которые в окислительно-восстановительных реакциях (реакции ДЕГИДРИРОВАНИЯ) - анаэробные ДГ. Пиридоксиновые коферменты содержат в своём составе витамин В6. ПАФ - ПИРИДОКСАМИНОФОСФАТ. ПФ - ПИРИДОКСАЛЬФОСФАТ. Участвует в реакциях превращения АК: 1.Реакции ПЕРЕАМИНИРОВАНИЯ (ТРАНСАМИНИРОВАНИЕ). Связан с ферментами АМИНОТРАНСФЕРАЗАМИ. 2.РЕАКЦИИ ДЕКАРБОКСИЛИРОВАНИЯ АК. Невитаминные коферменты: Не содержат в своём составе витаминов, но участвуют в каталитических превращениях. 1.НУКЛЕОТИДЫ: АТФ, ЦТФ (синтез ФОСФОЛИПИДОВ); УДФ, УТФ, ГТФ (синтез ГЛИКОГЕНА). 2.ПРОИЗВОДНЫЕ ПОРФИРИНА: ГЕМ, ЦИТОХРОМЫ, КАТАЛАЗА. 3.ПЕПТИДЫ: ГЛУТАТИОН – ТРИПЕПТИД, содержащий ГЛУ-ЦИС-ГЛИ. Он связан с ферментами ОКСИДОРЕДУКТАЗАМИ. Участвует в окислительно-восстановительных реакциях. Тиаминовые коферменты, ТДФ.
|
||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 876; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.230.44 (0.008 с.) |