

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Структурная организация межклеточного матрикса (суставной хрящ, базальные мембраны, субэпителиальные слои)
Содержание книги
- Тема 3. 5. Трансляция как механизм перевода генетической информации в фенотипические
- Тема 3. 6. Ингибиторы матричных биосинтезов: лекарственные препараты, яды и бактериальные токсины
- Тема 3. 7. Механизмы адаптивной регуляции активности генов у прокариотов и эукариотов
- Тема 3. 8. Механизмы, обеспечивающие разнообразие белков у эукариотов
- Тема 3. 9. Механизмы генетической изменчивости: эволюционная изменчивость, полиморфизм белков. Наследственные болезни
- Тема 3. 10. Использование рекомбинантных днк
- Использование техники рекомбинанатных днк для диагностики и лечения заболеваний
- Инактивация аденилатциклазы и протеинкиназы А
- Последовательность событий передачи сигнала первичных мессенджеров с помощью инозитолфосфатной системы
- Первый этап тканевого дыхания - дегидрирование различных субстратов, образующихся в реакциях катаболизма.
- Тема 5. 4. Сопряжение тканевого дыхания и синтеза атф
- В реакциях цпэ часть энергии не превращается в энергию макроэргических связей атф, А рассеивается в виде теплоты.
- Окислительное декарбоксилирование пирувата
- Кроме того, адф аллостерически активирует некоторые ферменты опк
- Тема 5. 12. Гипоэнергетические состояния
- Желудочный сок не содержит ферментов, расщепляющих пищевые углеводы. Амилаза слюны инактивируется в желудке, так как оптимальное
- Тема 6. 3. Синтез гликогена (гликогеногенез), мобилизация гликогена (гликогенолиз). Регуляция процессов
- Активация гликогенфосфорилазы адреналином посредством аденилатциклазной системы
- В аэробном и анаэробном гликолизе можно выделить два этапа.
- Тема 6. 6. Биологическое значение катаболизма глюкозы. Регуляция процесса
- Анаболическое значение катаболизма глюкозы.
- Тема 6. 7. Пентозофосфатный путь превращения
- А - окислительный этап; б - неокслительный этап в обратном направлении
- Тема 6. 9. Регуляция гликолиза и глюконеогенеза
- Регуляция активности пируваткиназы в печени осуществляется путем фосфорилирования (дефосфорилирования) в зависимости от ритма питания
- Структурная организация межклеточного матрикса (суставной хрящ, базальные мембраны, субэпителиальные слои)
- Гликозилирование лизина под действием гликозилтрансфераз прекращается по мере формирования трехспиральной структуры.
- Патологий, связанных с уменьшением эластичности сосудов. При недостаточной активности металлопротеиназ развивается фиброз тканей и неадекватный иммунный ответ.
- Хондроитинсульфат; 2 - кератансульфат; 3 - коровый белок; гк - гиалуроновая кислота
- Тема 7. 5. Структурная организация межклеточного матрикса (суставной хрящ, базальные мембраны, субэпителиальные слои)
- Регуляция процесса. Амф, гмф, имф, ди- и трифосфаты адениловых и гуаниловых нуклеотидов ингибируют ключевые реакции своего синтезааллостерически по механизму отрицательной обратной связи.
- Частым нарушением катаболизма пуринов является гиперурикемия, которая возникает, когда в плазме крови Концентрация мочевой кислоты превышает норму.
- Синтез цтф из утф осуществляет цтф-синтетаза, используя амидную группу глн и энергию атф для аминирования пиримидинового кольца.
- Тема 10. 3. Биосинтез дезоксирибонуклеотидов.
- Тема 10. 4. Механизмы действия противовирусных и противоопухолевых препаратов на ферменты синтеза рибо- и дезоксирибонуклеотидов
- И рецепторов. Особенно много сфинголипидов в нервной ткани, где они формируют миелиновые оболочки нейронов.
- Тема 8. 3. Хиломикроны - транспортная форма экзогенных жиров
- Модульная единица 2 биосинтез высших жирных кислот и жиров
- Реакции восстановления обеспечивают синтез насыщенного алифатического радикала жирных кислот
- Запасание жиров в жировой ткани - так называемое депонирование жиров - происходит в абсорбтивный период, когда увеличивается соотношение инсулин - глюкагон.
- Первичное ожирение развивается в результате алиментарного дисбаланса - избыточной калорийности питания по сравнению с расходами энергии.
- Модульная единица 3 жиры, жирные кислоты и кетоновые тела как источники энергии. Эйкозаноиды, Строение, синтез и биологические функции
- Скелетные мышцы и почки используют кетоновые тела даже при их низкой концентрации в крови.
- Выведение кетоновых тел, в том числе и ацетона, с мочой (кетонурия), потом выдыхаемым воздухом является способом выведения избытка кетоновых тел из организма и уменьшения таким образом ацидоза.
- Ацетильный остаток переносится с молекулы аспирина на oh-группу фермента и необратимо ингибирует его
- Модульная единица 4 обмен холестерола, его регуляция и транспорт кровью. Дислипопротеинемии. Биосинтез и функции желчных кислот. Желчнокаменная болезнь
- В поддержании гомеостаза холестерола в организме. Биохимия желчнокаменной болезни
- Тема 8. 14. Роль липопротеинов в транспорте
- Атеросклероз представляет собой заболевание, при котором поражается внутренний слой артерий за счет отложения холестерола в интиме сосудов.
- Тема 9. 2. Переваривание белков в желудке и кишечнике, всасывание аминокислот
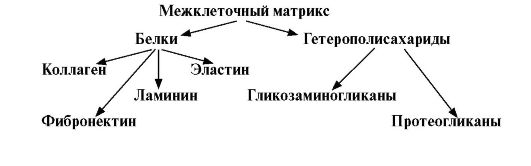 Межклеточный матрикс - это структурированный и упорядоченный комплекс макромолекул, который окружает клетки соединительной ткани и влияет на их развитие, организацию, пролиферацию и метаболизм. Он выполняет ряд важных функций: образует соединительную основу органов и тканей, связывает клетки друг с другом, обеспечивает механическую прочность и тургор тканей, образует высокоспециализированные структуры - базальные мембраны, кости, хрящи, сухожилия и др. Основными компонентами матрикса являются: структурные белки коллаген и эластин, гликозаминогликаны, протеогликаны, а также неколлагеновые белки фибронектин, ламинин, тенасцин, остеонектин и др. Межклеточный матрикс - это структурированный и упорядоченный комплекс макромолекул, который окружает клетки соединительной ткани и влияет на их развитие, организацию, пролиферацию и метаболизм. Он выполняет ряд важных функций: образует соединительную основу органов и тканей, связывает клетки друг с другом, обеспечивает механическую прочность и тургор тканей, образует высокоспециализированные структуры - базальные мембраны, кости, хрящи, сухожилия и др. Основными компонентами матрикса являются: структурные белки коллаген и эластин, гликозаминогликаны, протеогликаны, а также неколлагеновые белки фибронектин, ламинин, тенасцин, остеонектин и др.
ТЕМА 7.1. КОЛЛАГЕН
1. Коллаген - основной структурный белок межклеточного матрикса. Он синтезируется клетками соединительной ткани (остеобластами, хондробластами, фибробластами и др.). Это фибриллярный белок, отличающийся от других белков рядом особенностей состава и структуры:
• пептидная цепь коллагена содержит около 1000 аминокислотных остатков, из которых каждая третья аминокислота - глицин, 20% составляют пролин и гидроксипролин, 10% - аланин, оставшиеся 40% - другие аминокислоты; в коллагене отсутствуют цистеин и триптофан и содержится очень мало гистидина, метионина и тирозина;
• первичную структуру коллагена можно записать в виде [Гли-Х-У ]333, где Х - часто пролин, а У - гидроксипролин; особенности первичной структуры обеспечивают уникальную конформацию коллагена;
• полипептидная цепь коллагена укладывается в левозакрученную α-спираль, которая отличается от α-спирали глобулярных белков; она более развернута, и на один виток приходится три аминокислотных остатка, поэтому в цепи глицин всегда находится над глицином - это обстоятельство имеет важнейшее значение для последующей укладки коллагена и выполнения его функций; стабилизация этой цепи происходит преимущественно силами стерического отталкивания пирролидоновых колец пролина, так как водородных связей пролин и гидроксипролин не образуют;
• следующий уровень структурной организации коллагена - образование правозакрученной суперспирали из трех α-цепей, при формировании которой остатки глицина оказываются по ее центральной оси, что способствует образованию линейной молекулы тропоколлагена и включению ее в волокно.
2. Синтез и созревание коллагена - сложный многоэтапный процесс, который начинается в клетке, а завершается во внеклеточном пространстве (рис. 7.1). Он включает в себя целый ряд посттрансляционных изменений: гидроксилирование пролина и лизина, гликозилирование гидроксилизина, образование тройной спирали, отщепление N- и С-концевых пептидов.
 Рис. 7.1. Синтез и созревание коллагена Рис. 7.1. Синтез и созревание коллагена
Полипептидные цепи коллагена синтезируются на полирибосомах, связанных с мембраной ЭР, в виде предшественников, имеющих на N-конце «сигнальный» пептид. Основная функция этого пептида - ориентация синтеза пептидных цепей в полость ЭР, после выполнения которой этот пептид сразу же отщепляется. Гидроксилирование пролина и лизина начинается в период трансляции полипептидной цепи вплоть до ее отделения от рибосом. Эти реакции катализируют соответствующие гидроксилазы, которые содержат в активном центре железо в виде Fe2+. В реакции участвуют О2 и α-кетоглутарат, для поддержания железа в восстановленной форме необходимо присутствие витамина С. Введение ОН-группы в радикалы пролина и лизина способствует стабилизации цепей в молекуле тропоколлагена за счет образования водородных связей между ними (рис. 7.2). При недостатке витамина С этот процесс замедляется, снижается прочность и стабильность коллагеновых волокон, что приводит к возникновению цинги, симптомами которой являются кровоизлияния под кожу и слизистые, кровоточивость десен, анемия и др. Причина этого - повышенная ломкость и хрупкость кровеносных сосудов, которая приводит к повреждениям сосудистой стенки.
 Рис. 7.2. Гидроксилирование пролина в коллагене Рис. 7.2. Гидроксилирование пролина в коллагене
|