
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гликозилирование лизина под действием гликозилтрансфераз прекращается по мере формирования трехспиральной структуры.
N- и С-концевые пептиды проколлагена содержат остатки Цис, которые формируют внутри- и межцепочечные (только С-концевые пептиды) дисульфидные связи; эти пептиды необходимы для образования тройной спирали коллагена - при их отсутствии спирализация трехцепочечной структуры коллагена нарушается. Определенную роль в синтезе очень больших цепей пре-проколлагена играют белки-шапероны, которые обеспечивают «контроль их качества»: они способствуют правильному синтезу молекул коллагена и их транспорту по секреторным путям, а также «отслеживают» неправильно собранные молекулы коллагена, которые затем разрушаются. Внеклеточная стадия синтеза коллагена начинается с протеолиза N- и С-концевых неспирализованных участков, которые содержат соответственно 100 и 250 аминокислотных остатков, и образования тропоколлагена. Коллаген - это полиморфный белок. Известно 19 типов коллагена, которые отличаются друг от друга первичной структурой пептидных цепей, функциями и локализацией в организме. Разные типы коллагена в разных тканях могут образовывать такие структуры, как фибриллы, микрофибриллы, «заякоренные» фибриллы, сети и др. Фибриллообразующие коллагены (типы I, II, III, V и XI). Основа фибрилл - ступенчато расположенные параллельные ряды молекул тропоколлагена, которые сдвинуты на 1/4 друг относительно друга (рис. 7.3).
Преимущественное распределение этих типов коллагена по тканям следующее: I тип - кости, дентин, роговица, сухожилия; II тип - хрящи, межпозвоночные диски, стекловидное тело; III тип - почки, печень, сосуды, лимфатические узлы. Коллагены этих трех типов называют также интерстициальными, они образуют очень прочные фибриллы, которые выдерживают большие механические нагрузки. Стабилизация фибрилл обеспечивается поперечными связями между остатками лизина и аллизина - продукта окисления лизина в молекулах тропоколлагена. Эти типы связей встречаются не только в коллагене, но и в эластине. Модификацию радикалов лизина катализирует медьсодержащий ферментлизилоксидаза, который находится в межклеточном матриксе. Для этих реакций окислительного дезаминирования лизина и гидроксилизина необходимы также витамины РР и В6. Образовавшиеся реактивные альдегиды спонтанно формируют ковалент-
ные связи между собой, а также с другими остатками лизина или гидроксилизина соседних молекул, и в результате возникают поперечные Лиз-Лиз- сшивки (рис. 7.4). Кроме этих сшивок, между молекулами коллагена могут возникать перекрестные пиридиновые связи, в результате которых образуются пиридинолины (кости и хрящи) и дезоксипиридинолины (кости и дентин), что также способствует повышению прочности этих тканей. Эти структуры имеют важное значение в диагностике: при метастазах рака легких, простаты и молочной железы в кости они определяются в моче. Коллаген IV типа - структурный компонент базальных мембран - относится к сетеобразующим коллагенам. Особенностью этого коллагена является то, что повторяющиеся спирализованные участки с последовательностями [Гли-Х-У] часто прерываются короткими неспиральными сегментами,
А - образование альдольной поперечной сшивки из двух боковых цепей лизина; Б - образование шиффовых оснований из боковых цепей лизина и аллизина что, по-видимому, увеличивает гибкость коллагена IV типа и способствует формированию на его основе сетчатых структур. У коллагена IV типа N- и С-концевые пептиды не отщепляются. Именно эти фрагменты участвуют в образовании олигомерных форм коллагена, стабилизированных дисульфидными мостиками и поперечными лизиновыми связями. В базальной мембране из этих компонентов формируется сетчатая структура (рис. 7.5).
А - тройная спираль мономера; 7S - N-конец; НК1 - С-конец; Б - полимеризация коллагена IV типа: 1 - мономер; 2 - димеры, образованные соединением мономеров в области НК1-доменов; 3 - тетрамеры, образованнные соединением мономеров в области 7S-сегментов в параллельном и антипараллельном направленииях; 4 - образование сетчатой структуры из олигомерных форм коллагена IV типа Коллаген VII типа - основной структурный компонент «заякоренных» фибрилл, которые находятся преимущественно в субэпителиальных слоях. Фибриллы образуются димерами этого коллагена, которые соединяются между собой «бок-в-бок» (рис. 7.6). Пучки таких фибрилл участвуют в присоединении эпидермиса к дерме.
4. Катаболизм коллагена. Нативный коллаген гидролизуется ферментом коллагеназой, матриксной металлопротеиназой (ММР-1), которая расщепляет молекулу на два фрагмента (1/4 и 3/4 от общей длины молекулы) (рис. 7.7). После этого трехцепочечные фрагменты подвергаются протеолизу лизосомальными протеазами. Коллагеназа относится к группе Zп2+-зависимых протеолитических ферментов межклеточного матрикса, которые секретируются разными типами клеток и участвуют в деградации не только коллагена, но и ламинина, фибронектина и других структурных белков матрикса. Ион
1 - мономер коллагена VII типа (НК1 и НК2 - неколлагеновые домены у N- и С-конца); 2 - димер коллагена VII типа, молекулы собраны антипараллельно с перекрытиями на N-конце; 3 - димеры коллагена VII типа после удаления НК2-доменов; 4 - фибрилла, образованная димерами коллагена VII типа, соединенными бок в бок
Цинка находится в активном центре этих ферментов. В обычных условиях металлопротеиназы (ММР) содержатся в тканях в незначительных количествах. Они относятся к индуцируемым ферментам, синтез которых контролируется на уровне транскрипции рядом регуляторных молекул: цитокинами, эстрогеном, прогестероном и др. Небольшое количество ММР присутствует в матриксе в неактивной форме, так как ингибировано специфическим тканевым ингибитором матриксных металлопротеиназ (ТIМР). Это белки небольшого размера, способные формировать комплексы со многими членами семейства матриксных протеиназ. ТIМР может взаимодействовать с активной и неактивной формами ММР. Частичный протеолиз и активацию большинства ММР осуществляют протеазы: плазмин, урокиназа и др. Некоторые ММР могут активировать друг друга. Ингибиторы ММР могут быть инактивированы (разрушены протеолизом) с помощью ряда протеиназ: трипсина, химотрипсина, стро- мелизина-3 и эластазы нейтрофилов. В норме металлопротеиназы отвечают за важнейшие процессы - от эмбрионального развития до формирования иммунного ответа. Металлопротеиназы играют ключевую роль в развитии многих патологий. Например, избыточная активность этих ферментов ведет к разрушению гематоэнцефалического барьера, деструкции суставного хряща при ревматоидном артрите и остеоартрите, развитию сердечно-сосудистых
|
||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 274; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.171.235 (0.005 с.) |
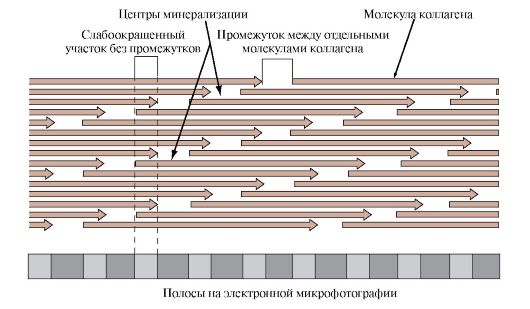 Рис. 7.3. Схема ступенчатого расположения молекул коллагена в коллагеновой фибрилле
Рис. 7.3. Схема ступенчатого расположения молекул коллагена в коллагеновой фибрилле Рис. 7.4. Образование поперечных связей в коллагене:
Рис. 7.4. Образование поперечных связей в коллагене: Рис. 7.5. Организация коллагена IV типа:
Рис. 7.5. Организация коллагена IV типа: Рис. 7.6. Организация коллагена VII типа:
Рис. 7.6. Организация коллагена VII типа: Рис. 7.7. Расщепление тройной спирали коллагена тканевой коллагеназой
Рис. 7.7. Расщепление тройной спирали коллагена тканевой коллагеназой


