
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 4. Количественный химический анализСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Глава 4. Количественный химический анализ Титриметрический анализ Количественный анализ вещества это экспериментальное определение (измерение) содержания химических элементов, соединений или их форм в анализируемом веществе, выраженное в численном виде. Цель количественного анализа – определение содержания (концентрации) компонентов в образце.Его можно осуществлять, используя различные методы: химические, физико-химические, физические, биологические. Химические методы включают гравиметрические (весовые) и титриметрические или объемные виды анализа. Гравиметрические методы основаны на точном измерении массы определяемого компонента, либо количественно связанного с ним соединения с точно известным составом. Под титриметрическим анализом понимают определение содержания вещества по точно измеренному количеству реагента (массе или объему), вступившего в реакцию с определяемым компонентом в эквивалентном количестве. Методы количественного химического анализа не требуют сложной аппаратуры, обладают хорошей точностью и воспроизводимостью. Так как погрешность многих титриметрических методов не превышает ± 0,5 ¸ 0,1%, а гравиметрических – не более 0,1%, то эти методы до сих пор используются в качестве метрологических при проведении аттестации методик анализа. Однако им присущ ряд недостатков. Наиболее существенными являются - недостаточная селективность и чувствительность, что требует тщательной подготовки пробы и применяемых реагентов. Для проведения химического анализа используют реактивы следующих квалификаций: ч. (чистые), ч.д.а. – чистые для анализа; х.ч. – химически чистые; о.с.ч. – особо чистые. Наименьшее содержание примесей имеют реагенты марки о.с.ч. и ч.д.а., тогда как реактивыквалификации х.ч. (чистые)и ниже не всегда пригодны для количественных определений и требуют дополнительной очистки. Качество полученных результатов во многом определяется правильностью подбора посуды и оборудования. Для проведения количественного анализа используют самую разнообразную лабораторную посуду и весы. По назначению ее классифицируют на: Ø посуду специального назначения – применяется для выполнения узкого круга операций. Это различного рода пикнометры, ареометры, холодильники, круглодонные колбы, колбы Кьельдаля;
Ø посуду общего назначения – наиболее часто применяемая в самых разных видах работ: кипячении, титровании, фильтрации и т.д. Это пробирки, воронки, химические стаканы, плоскодонные круглые и конические колбы (Эрленмейера), кристаллизаторы, чашки Петри, бюксы, эксикаторы (рис. 4.1 и 4.2);
Рисунок 4.1 – лабораторная посуда общего назначения, применяемая в различных методах анализа.
Рисунок 4.2 – посуда общего назначения: а) стеклянные бюксы с крышками для взвешивания и хранения гигроскопичных веществ; б) различного вида промывалки для ополаскивания посуды.
Ø мерную посуда – служит для измерения объемов жидкости. Ее делят на посуду точного измерения: пипетки (Мора и градуированные), бюретки, мерные колбы Мора (рис.4.3) и неточную измерительную посуду: мерные цилиндры, мензурки, стаканы, колбы с делениями, градуированные пробирки: цилиндрические и конические или пальчиковые (рис. 4.4).
Рисунок 4.3 - посуда для точного измерения объема, применяемая при отборе аликвот, приготовлении стандартных растворов и в титровании.
Рисунок 4.4 - Посуда для неточного измерения объема, применяемая для приготовлении растворов подлежащих стандартизации и реагентов в качественном анализе.
Для взятия аликвот в титриметрии, при количественном осаждении из растворов, а также при приготовлении стандартных растворов различного назначения используют всегда толькопосуду точного измерения и аналитические весы! Посуду для неточного измерения объема и технохимические весы применяют: при приготовлении стандартизируемых растворов, измерении объемов растворов, применяемых для поддержании кислотности среды (буферов), проведения осаждения и титрования аликвот. При работе с мерной посудой, особенно точной, необходимо соблюдать ее чистоту. С этой целью посуду перед применением всегда ополаскиваютдистиллированной водой и сушат. Точную посуду сушат на воздухе с применением эфира или спирта, а неточную и общего назначения – на сушилках с обогревом или в сушильном шкафу. Для исключения ошибки при отборе аликвот и работе с бюретками, их дополнительно ополаскивают еще и измеряемым раствором.
Изменение температуры среды приводит к возникновению погрешности измерения: завышению или занижению определяемого объема, а значит и рассчитываемой концентрации. Поэтому, вся мерная посуда имеет штамп с указанием ее объема при 20ºС, а посуду точного измерения - дополнительно калибруют дистиллированной водой, используя аналитические весы и внося поправку на плотность воды при данной температуре. Иногда имеется дополнительная маркировка, указывающая на термостойкость и химическую устойчивость. Термостойкость стекла обозначается матовым квадратом или кругом. В такой посуде нагревают и кипятят жидкости на плитках и газовых горелках. Весы. Устройства, применяемые для определения массы тел называют весами. В химическом анализе используют два вида весов: технические и аналитические. Они могут быть как механическими, так и электронными; иметь одну чашку (квадрантные механические и электронные) или две (чашечные и демпферные весы). Под взвешиванием понимают сравнение массы данного предмета с массой калиброванных грузов (разновесов) или же измерение давления, которое предмет оказывает на чашку весов в пересчете его на единицы массы. Разновесы необходимы при работе на демпферных иличашечных весах, а в квадрантных и электронных одночашечных весах шкалы уже проградуированы в единицах массы. Весы различаются по классу точности и пределам измерения. Технические весы – наименее точные и применяются для взвешивания относительно больших по массе образцов. Для химических целей обычно используют квадрантные или чашечные технические весы на 0,2 – 1 кг (иногда до 5 кг). Точность их не превышает 0,01 – 20 г. Технические весы с точностью 0,1 – 0,01 г называют технохимическими и используют в лаборатории для взятия навесок от 1 до 500 г. В современных электронных технических весах точность измерений может быть и выше: при предельной массе предмета в 500 г, она варьирует от 0,001 г до 0,2 г. Аналитические весы служат для точного определения массы навески при приготовлении стандартных растворов, проведении гравиметрических измерений и др. Точность демпферных весов составляет ± 2×10-4 - 2×10-5 г, а электронных - до 2×10-6 г. В среднем такие весы рассчитаны на предельную массу предмета 50 – 200 г, но выпускаются весы и повышенной точности на предельную массу навески 1 – 20 г, которые применяют в некоторых видах инструментального анализа, например в спектральном. При работе на весах необходимо строго соблюдать правила обращения с ними. Из-за неправильной установки или небрежного обращения можно получить недостоверные результаты, а также вывести весы из строя. Особенно это важно помнить при использовании электронных и аналитических демпферных весов. Индикаторы и их подбор Для обнаружения точки эквивалентности в титриметрическом анализе применяют индикаторы (от лат. indicare – показывать, обнаруживать). Индикаторами называют реагенты, способные контрастно изменять свой цвет в зависимости от изменения свойств среды. Чаще всего – это органические вещества с обратимо изменяющейся окраской (исключение – осадительные индикаторы). Далеко не любое вещество, изменяющее свою окраску в зависимости от свойств среды, пригодно в качестве индикатора титрования. Тем более, что индикаторы изменяют свой цвет независимо от того, достигнута или еще не достигнута точка эквивалентности: определяющим моментом являются лишь параметры среды. Поэтому важно правильно подобрать индикатор. К необходимым требованиям при подборе индикатора относятся следующие:
Ø показатель титрования рТ (интервал перехода окраски индикатора) должен находится в области скачка и быть как можно ближе к точке эквивалентности, а значение индикаторной ошибки не может превышать 0,5%; Ø цвет индикатора - очень интенсивный и четко фиксируется в растворе визуально даже при сильном разбавлении (для 1 - 2 капель индикатора); Ø чувствительность индикаторного вещества к изменению свойств среды – высокая, чтобы изменение окраски происходило при минимальном избытке титранта в растворе (от 1 – 2 капель титранта); Ø интервал перехода - узкий и высококонтрастный; Ø индикатор должен быть стабилен - не разлагаться на воздухе и в растворе; Ø вещество индикатора - индифферентно по отношению к титруемому раствору или продуктами титрования, т. е. не должны протекать между ними реакции, влияющие на ход кривой титрования. В зависимости от свойств, индикаторы классифицируют по числу переходов (одно и многопереходные) и по области применения. К однопереходным относится фенолфталеин (малиновый – бесцветный), а к многопереходным – метиловый оранжевый (желтый – оранжевый и оранжевый – розовый). Примерами других многопереходных индикаторов являются: a-Нафтолбензеин - два перехода: зеленый – желтый (рН = 0 – 1) и желтый – синий (рН = 8,4 – 10); Метиловый фиолетовый – три перехода (желтый – зеленый, зеленый – синий, синий – фиолетовый); Крезоловый красный – два перехода (красный – желтый и желтый – пурпурный). К многопереходным относятся также универсальные индикаторы. Иногда многопереходные индикаторы в титровании используются как однопереходные, если изменение цвета не всех переходов происходит в относительно узком диапазоне значений или же они фиксируются не четко. По области применения различают следующие группы индикаторов: 1. Кислотно – основные. 2. Редокс – индикаторы (окислительно-восстановительнгые). 3. Металлохромные (комплексообразователи). 4. Осадительные. 5. Адсорбционные. 6. Специфические. 7. Смешанные. 8. Люминесцентные (флуоресцентные) и металлофлуоресцентные. 9. Экстракционные. 10. Экранирующие. Это деление достаточно условно, так как в ходе титрования нередко закономерно изменяются одновременно несколько параметров, которые коррелируют между собой. Например, рН и потенциал системы Е, рН и значение ПР (произведения растворимости). Существует и более полная классификация индикаторов, учитывающая как их химическое строение, так и механизм изменения окраски, но такая классификация достаточно сложна и рассматриваться нами не будет.
Хромофорная теория (ХТ) Изменение окраски индикатора по ХТ связано с обратимыми структурными процессами (изомеризацией), протекающими за счет внутримолекулярных перегруппировок отдельных функциональный групп в молекуле. Каждая из структурных форм (таутомеров) устойчива только в определенном интервале значений рН или других параметров среды, поэтому присоединение или отщепление протона приводит к перестройке молекулы индикатора, в результате которой появляются новые или исчезают существовавшие раньше функциональные группы, ответственные за окраску (хромофоры). Эти особенности объясняют почему изменение окраски ряда индикаторов протекает не мгновенно, а растянуто во времени, поскольку таутомерные превращения – это внутримолекулярные перегруппировки, которые в отличие от ионных реакций (диссоциации) осуществляются медленнее. Функциональные группы, отвечающие за окраску индикаторного вещества, получили название хромоморфных (хромо – цветной). К ним относятся: нитрогруппа (О = N –); азогруппа (– N = N –), несколько близко расположенных друг к другу карбонильных групп (>С=О). Функциональные группы, усиливающие или стабилизирующие окраску индикатора, называются ауксохромными. Подобными свойствами обладают: аминогруппы (–NH2) и производные аминов; кислород– и азот–содержащие соединения (–О–CH3; –N(CH3)2; –N(C2H5)2), гидроксогруппы (электронодонорные). Окраска индикатора проявляется ярче, если вещество содержит кроме ауксохромных групп, еще и антиауксохромные (электрофильные) группы, обеспечивающие сдвиг электронной плотности в молекуле. Электрофильными свойствами обладают, например, некоторые кислородсодержащие радикалы (-NO2, -NO, -COCH3). В качестве примера приведем структурные формулы таутомерных изомеров однопереходного индикатора п-нитрофенола (рис. 4.8)
Рисунок 4.8 – Структура таутомерных форм индикаторного вещества (п-нитрофенола), содержащего хромофорную и ауксохромную группы.
Хромофорная теория также имеет ряд недостатков, в частности: Ø не объясняет, почему изменение окраски и таутомерные превращения зависят от значения рН среды; Ø каким образом окраска большинства индикаторов, имеющих хромофорные группы, изменяется практически мгновенно, что противоречит механизму внутримолекулярной перегруппировки; Ø и, наконец, хромофорная теория не поддается количественному описанию. Ионно-хромофорная теория. Эта теория объединила представления ионной (диссоциативной) и хромофорной теорий. Согласно ионно-хромофорной теории, кислотно-основные индикаторы – слабые кислоты и основания, причем нейтральные молекулы и их ионизированные формы содержат разные хромофорные группы. В водном растворе молекула индикатора способна либо отдавать ионы водорода (слабая кислота), либо принимать их (слабое основание), подвергаясь при этом таутомерным превращениям согласно схеме:
HInd Û H+ + Ind- Û H+ + Ind-B, где HInd - неионизированная молекула индикатора (слабая кислота, таутомерная форма I); Ind-B - анион сильной кислоты, имеющей таутомерную форму II в диссоциированном состоянии (основная форма II). При понижении рН (подкисление раствора) равновесие в системе смещается влево в сторону неионизированной формы HInd. Как только она начинает доминировать, раствор приобретает ее окраску. Если раствор подщелачивать (рН увеличивается, а концентрация H+ - убывает) – равновесие в системе смещается вправо и доминирующей формой становится Ind-B, которая и придает раствору иную окраску, характерную уже для основной формы II. Так кислая форма фенолфталеина (рН = 8,2) – бесцветна, а при переходе в щелочную среду – образуется анион таутомерной основной формы (рН = 10), окрашенный в красно-малиновый цвет. Между этими формами существует диапазон значений рН (от 8,2 до 10), соответствующих постепенному изменению окраски индикатора. Глаз человека способен воспринимать окраску только одной из двух форм в смеси, при условии одинаковой интенсивности их цвета, если концентрация одной из этих форм примерно в 10 раз выше, чем второй. Индикаторов. 1. Кислотно – основные индикаторы – это слабые органические кислоты или основания. Окраска индикаторов обратима и определяется значением рН среды. Интервал перехода рассчитывается через константу диссоциации: DрНинд. = – logКа ± 1, где Ка – константа диссоциации индикатора. Рассмотрим пример. Константа диссоциации индикатора ализаринового желтого Ка = 10-11. Определим интервал перехода индикатора DрНинд: DрНинд. = – log (10-11)± 1 =11 ±1 Þ DрНинд [(11-1) ¸ (11+1)] = [10 ¸ 12]. Интервал перехода индикатора DрНинд = 10 ¸ 12.
2. Редокс – индикаторы – органические вещества, проявляющие свойства слабых окислителей или восстановителей. Могут быть как обратимыми (дифениламин), так и необратимыми, окраска которых разрушается (метиловый красный, метиловый оранжевый, они известны также как кислотно-основные индикаторы). Изменению окраски индикатора соответствует обратимая реакция: Ind+ + ne Û Ind; где Ind+ - окисленная (Ox), а Ind - восстановленная (Red) формы индикатора, n - число электронов в данной полуреакции. Изменение редокс- потенциала (интервал перехода индикатора) рассчитывают по уравнению Нернста: DЕ = Е0 ± 0,059/n, где Е0 - стандартный редокс-потенциал для индикатора; n – число электронов в полуреакции. Например: Редокс-индикатор дифениламин имеет Е0 = + 0,76 В и n = 2. Определим интервал его перехода. Согласно формуле: DЕ = 0,76 ± 0,059/2 = 0,76 ± 0,0295 Þ DЕ = (0,76 –0,0295 ) ¸ (0,76 + 0,295) = 0,73 ¸ 0,79 (В).
3. Металлохромные (металлоиндикаторы) - это органические красители (слабые кислоты), имеющие собственные хромофорные группы,и обратимо изменяющие свой цвет при образовании комплексной соли с катионами металлов. Используют их преимущественно в комплексонометрии, например, эриохром черный Т. Для этих индикаторов дополнительно должно выполняться условие: устойчивость комплекса титруемого вещества с титрантом выше, чем комплексов, образуемых им с индикатором в растворе. Интервал перехода вычисляют по формуле: DрМе = – logКуст. ± 1, где Куст - константа устойчивости комплекса, образованного данным индикатором с титруемым веществом.
4. Осадительные индикаторы. Группа индикаторов незначительна по составу, так как окрашенный осадок должен формироваться в растворе сразу же после практически полного осаждения определяемого вещества (остаточная концентрация менее 10–6 моль/дм3), а таких веществ немного. Интервал перехода индикатора определяют по значению произведения растворимости (ПР), образованного им осадка: Dр(ПР) = – logПР. ± 1.
Адсорбционные индикаторы -это органические вещества, проявляющие свойства слабых кислот или оснований, такие как эозин или флуоресцеин. Механизм действия адсорбционного индикатора показан на схеме (рис. 4.9). Как видно из рисунка 4.9, появление окраски происходит в результате изменения состава ионов на поверхности дисперсной фазы (осадок или коллоидная частица) за счет процессов адсорбции или десорбции ионов индикатора. Это явление объясняется сменой знака электростатического заряда поверхности частиц осадка в ходе титрования. Причина ее в том, что в недотитрованном растворе поверхность осадка преимущественно сорбирует титруемые ионы, которые входят в его состав (осадок AgCl сорбирует неоттитрованные ионы Cl-) и приобретает их заряд. В результате этого сорбция ионов индикатора становится невозможной.
а б
Рисунок 4.9 – Схематическое изображение структуры сорбированного слоя на поверхности осадка AgCl, образующегося при титровании ионов Cl- раствором AgNO3. а – до точки эквивалентности (поверхностью сорбируются ионы Cl-, а ионы индикатора Ind- остаются в растворе); б – после точки эквивалентности (поверхность сорбирует ионы титранта Ag+, которые притягивают ионы индикатора Ind-).
Как только будет достигнута точка эквивалентности, в растворе появится избыток противоположно заряженных ионов титранта, которые также начнут скапливаться вблизи поверхности осадка, притягивая из раствора ионы индикатора. Образующееся в результате этого вещество окрашивает поверхность осадка.
5. Специфические индикаторы – Относительно малочисленная группа индикаторов, так как в основе их применения специфические реакции с титруемом веществом. Такими свойствами обладает раствор крахмала по отношению к молекулам J2: образование соединения синего цвета.
Способы титрования. Так как напрямую, реакцией с титрантом, можно анализировать далеко не любое вещество, особенно, если оно неустойчиво на воздухе, то для решения подобных задач было разработано несколько приемов (способов) проведения анализа. Они позволяют заменять неустойчивые, в данных условиях соединения, на эквивалентное количество более устойчивого, которое не подвергается гидролизу или окислению. Известны следующие основные способы проведения титриметрического анализа: Ø прямое титрование; Ø реверсивное; Ø обратное титрование или титрование по остатку; Ø косвенное титрование или по замещению (по заместителю). В таблице 4.1 показаны области применения различных способов в зависимости от вида титрования.
Таблица 4.1 – Применение различных видов и способов титрования.
Рассмотрим подробнее суть различных способов титрования. 1. Прямое титрование заключается в непосредственном взаимодействии титранта и титруемого вещества. В процессе титрования к аликвоте или навеске вещества постепенно добавляют раствор титранта, объем которого точно фиксируют в Т. Э.В качестве титранта используют рабочий раствор известной концентрации. Расчет содержания вещества в образце выполняют по закону эквивалентов:
где Концентрацию компонента А в растворе вычисляют по формуле:
где
Метод применяется во всех случаях, когда нет каких-либо ограничений. Например, при анализе кислот, определении жесткости воды.
2. Реверсивное титрование – это разновидность прямого титрования, когда рабочий и титруемый растворы меняют местами. В этом случае для анализаотбирают аликвоты рабочего раствора, а в Т.Э. измеряютизрасходованный натитрование объем анализируемого раствора. Вычисления проводят также, как и в прямом титровании, по формулам (4.2) или (4.3). Метод позволяет ограничить площадь поверхности раствора, контактирующей с воздухом, при стандартизации относительно неустойчивых соединений, как например NaOH.
Титрование по заместителю (косвенное) и титрование по остатку(обратное) основаны на использовании вспомогательного раствора, взаимодействующего с определяемым компонентом. Такой прием позволяет выполнять анализ химически нестойких объектов или же при отсутствии подходящего индикатора.
В косвенном титровании сначала осуществляют реакцию определяемоговещества А со вспомогательным раствором В, а затемтитруют эквивалентное количество образовавшегося продукта реакции С (заместитель). Этот способ можно представить в виде схемы: А + В
Из равенства (4.4) следует, что
Вобратном титровании также сначала протекает реакция между определяемымвеществом А ивзятым в избыткевспомогательным раствором В, но затем титруют остаток не прореагировавшего вспомогательного раствора. Поэтому необходимо точно знать концентрацию вспомогательного раствора В и его объем, взятый для анализа. Определение компонента А выполняется согласно схеме: А + В
Откуда имеем:
Если все вещества взяты в виде растворов, то формула (4.6) примет вид
Если хотя бы одно из веществ взято в сухом виде (известна его масса), то следует воспользоваться выражением (4.6) и записать значение
И способы их приготовления. В титриметрии используют растворы, концентрация которых установлена каким-либо способом с высокой степенью точности. Такие растворы называют стандартными титрованными или просто титрованными. Растворы классифицируют по назначению и по способу установления их концентрации. По назначению их условно делят на рабочие растворы и растворы стандартов (первичные и вторичные). Рабочими называют растворы, которые используются непосредственно в анализе при определении содержания вещества. Если рабочий раствор не относится к стандартным, то его необходимо отстандартизировать непосредственно перед выполнением анализа, так как концентрация в процессе хранения могла существенно измениться. Точную концентрацию рабочего раствора находят путем титрования стандартного раствора или установочных веществ (метод точных навесок). Это касается, например, таких рабочих растворов, как: NaOH, Na2S2O3×5H2O. Под стандартным раствором понимают такой титрованный раствор, который устойчиво сохраняет свою концентрацию при длительном хранении. Основное назначениестандартных растворов - определение точной концентрации рабочих и иных растворов, применяемых в титровании. Процесс установления точной концентрации раствора путем его титрования по стандарту называется стандартизацией. По способу определения концентрации различают первичные стандарты или растворы с приготовленным титром и стандартизированные растворы. Стандартизированные растворы - это такие растворы, концентрация которых устанавливается по стандарту и заранее не может быть точно определена. К ним относятся растворы кислот, щелочей, гидролизующихся и гигроскопичных солей, а также веществ, которые могут реагировать с атмосферным кислородом и углекислотой. Известно множествоспособовприготовления стандартизированных растворов. Наиболее часто для этой цели применяют: приготовление по приближенной навеске (щелочи, соли), методы разбавления или смешения растворов (кислоты, соли), методы ионного обмена (растворы солей). Стандартные растворыклассифицируют по способу определения их концентрации. Различают: первичные стандарты или растворы с приготовленным титром и вторичные стандарты - растворы с установленным титром. Первичные стандарты - это растворы, которые готовят либо по точной навеске вещества (рис. 4.10), либо путем разведения специально приготовленных стандартизированных реагентов – фиксаналов (рис. 4.11). Фиксанал представляет собой стеклянную запаянную ампулу, выпускаемую промышленностью и содержащую строго нормированное количество реагента, обычно рассчитанного на 1 л 0,1 н. раствора. Приготовление раствора по точной навеске начинают с расчета ее массы по заданной концентрации (титру или нормальности) и объему колбы. Навеску стандартного вещества взвешивают на аналитических весах с точностью до 1×10-4 г и количественно переносят в мерную колбу, где ее растворяют при перемешивании (рис. 4.10).
Рисунок 4.10 – Порядок операций при приготовлении раствора первичного стандарта по точной навеске: 1 – мерная колба Мора; 2 – воронка; 3 – бюкс с навеской вещества; 4 – промывалка с дистиллированной водой; 5 – пипетка или капельница. а – перенос навески вещества в мерную колбу; б – ополаскивание воронки; в – доведение объема раствора стандарта до метки.
Этим методом обычно готовят растворы солей, таких как бура (Na2B4O7×10H2O), K2Cr2O7. Количество вещества в растворе находят или по значению точно взятой массы навески (при ее переносе необходимо тщательно промыть бюкс), или рассчитывают методом разности, определяя точную массу бюкса сначала с навеской, а затем – пустого, уже после переноса вещества в колбу. В случае необходимости - концентрацию раствора заново пересчитывают с учетом фактически взятой массы навески. Порядок приготовления раствора методом разведения из фиксанала показан на рисунке 4.11. Чтобы стандарт, полученный этим методом, был качественным и отвечал всем требованиям, необходимо исключить потери вещества при вскрытии ампулы и переносе его в колбу, а также следить, чтобы осколки ампулы не попали в раствор. Это во многом зависит от правильности обращения с ампулой.
Рисунок 4.11 – Способ приготовления растворов первичного стандарта методом разведения из фиксанала: 1 – мерная колба Мора на 1л; 2 – нижний боек; 3 – воронка; 4 – ампула фиксанала; 5 – верхний боек.
Перед использованием, ампулу следует ополоснуть дистиллированной водой и только затем ее вскрывать специальным бойком. Сразу же после переноса вещества в колбу, нужно тщательно промыть ампулу дистиллированной водой, не менее, чем 6-ти кратным ее объемом. Этот метод приготовления первичного стандарта проще, чем по точным навескам, но уступает ему в точности. Его используют не только для получения растворов солей, но и различных кислот. Так как для приготовления раствора первичного стандарта пригодны только точная мерная посуда и аналитические весы, то и к веществам, применяемым для этой цели, предъявляют ряд обязательных требований. В качестве первичного стандарта можно использовать только такие реактивы, которые характеризуются: Ø высокой чистотой (обычно не хуже, чем 99,99 – 99,999% - квалификации ч.д.а. и о.с.ч.); Ø точным соответствием формульному составу и относительно высокой молекулярной массой; Ø устойчивостью при хранении как в твердом виде, так и в растворе (отсутствие процессов гидратации, гидролиза, окисления и карбонизации); Ø простотой в приготовлении и хорошей растворимостью; Ø необратимостью реакции при стандартизации, селективностью; Ø возможностью точной фиксации Т. Э. каким-либо методом. Вторичным стандартом называют такие стандартизированные растворы, которые устойчивы при хранении и могут быть использованы для стандартизации других растворов. Вторичные стандарты готовят как растворы приблизительной концентрации любым известным методом, а перед употреблением - определяют их точную концентрацию путем стандартизациипо первичному стандарту. Поэтому при приготовлении вторичных стандартов не требуется высокая точность измерения массы вещества или объема раствора, как в случае первичных стандартов. Для этой цели вполне пригодны технохимические весы и неточная мерная посуда (цилиндры, мензурки, градуированные пробирки). Примером раствора, обладающего свойствами вторичного стандарта, является соляная кислота. Ее разбавленные растворы могут храниться длительное время, до 1-го месяца и более, без заметного изменения концентрации. Бура, используемая в протолитометрии для стандартизации HCl, относится к первичным стандартам и готовится по точной навеске. Тогда, как рабочий раствор NaOH – свойствами стандарта не обладает вообще и его концентрацию приходится устанавливать заново при каждом использовании. И их применение в анализе
При п
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 3355; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.165.235 (0.02 с.) |





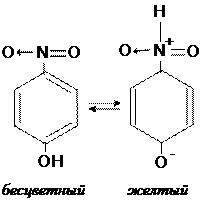

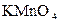 )
)
 и
и  )
)
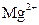
 )
)
 осадок
осадок
 ,
,  ,
,  ;
;  ,
, 
 =
=  (4.1)
(4.1) -количество моль-эквивалентов титранта, вступившего в реакцию с определяемым компонентом А.
-количество моль-эквивалентов титранта, вступившего в реакцию с определяемым компонентом А. (4.2)
(4.2) – молярная концентрация эквивалента (нормальность) титруемого раствора (определяемого компонента), моль-экв/л;
– молярная концентрация эквивалента (нормальность) титруемого раствора (определяемого компонента), моль-экв/л;  – объем аликвоты титруемого раствора, мл;
– объем аликвоты титруемого раствора, мл;  – концентрация и
– концентрация и  - объем титранта в точке эквивалентности. При титровании методом отдельных навесок формула (4.2) преобразуется в выражение (4.3):
- объем титранта в точке эквивалентности. При титровании методом отдельных навесок формула (4.2) преобразуется в выражение (4.3): (4.3)
(4.3) С + (т-т), исходя из которой запишем выражение для закона эквивалентов:
С + (т-т), исходя из которой запишем выражение для закона эквивалентов: =
=  . (4.4)
. (4.4) –
–  (4.7)
(4.7) для каждого из веществ индивидуально.
для каждого из веществ индивидуально.




