
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Среды. Формальный потенциал.Содержание книги
Поиск на нашем сайте Для проведения приближенных расчетов хода кривой титрования в редоксиметрии достаточно воспользоваться приведенными выше уравнениями Нернста (4.47) или (4.48), где не учитывается влияние кислотности среды на величину редокс-потенциала. Анализ этих уравнений позволяет определить факторы, влияющие на ход кривой титрования и положение точки эквивалентности. Равновесные концентрации веществ в точке эквивалентности и в других точках кривой титрования зависят от константы равновесия, которая, в свою очередь, определяется разностью стандартных потенциалов. Чем больше разность стандартных потенциалов, тем больше константа равновесия и тем больше скачок титрования. 1. Величина скачка кривой титрования будет зависеть от разностистандартных редокс-потенциалов титранта и титруемого вещества, т.е. от значения э.д.с. реакции (Е). Стандартным окислительно-восстановительным потенциалом называется потенциал системы, в которой все участники полуреакции находятся в стандартном состоянии, а растворенные вещества – в стандартном растворе. Так как Е=Е0ок. – Е0вос., то, чем больше различие стандартных потенциалов окислителя и восстановителя, тем больше скачок. Чем выше положительное значение ЭДС, тем более сильным является окислитель. Пары с более высоким стандартным потенциалом могут окислять системы, обладающие меньшим стандартным потенциалом. Эта зависимость может быть использована для предсказания направления реакции в растворе. 2 Концентрации растворов. В отличие от протолитометрии, концентрация растворов практически не влияет на величину скачка, а положение точки эквивалентности в области скачка может быть произвольным и зависит только от значения стехиометрических коэффициентов уравнения Нернста. Это закономерность обусловлена тем, что в расчете участвует отношение концентраций окисленной и восстановленной форм одного и того же вещества. 3. Температурасреды. В данном виде титрования температурный фактор играет существенную роль, так как он влияет на величину потенциала системы (уравнение 4.47). Чем выше температура, тем меньше скачок. Поэтому, редоксиметрические определения предпочтительно проводит при комнатной температуре. Уменьшение редокс-потенциала системы с температурой может привести даже к полному прекращению реакции. 4. Влияние кислотности среды. Рассмотренное выше уравнение Нернста (4.47) справедливо для таких процессов, в которых кислотность среды не играет существенной роли, так как они протекают без участия протонов. Однако таких реакций ОВР не так много. В том случае, если реакция протекает с участием Н+- или ОН- - ионов, то в уравнении Нернста появляется член, учитывающий кислотность среды – рН. Пусть уравнение полуреакции имеет вид: aOx + dH+ + ze- = bRed, тогда уравнение Нернста преобразуется к виду:
где а, b и d – стехиометрические коэффициенты в полуреакции. При переходе к 250С и десятичному логарифму получаем:
Учитывая, что log[H+] = -pH, имеем окончательное выражение влияния кислотности среды на редокс-потенциал:
В качестве примера влияния кислотности среды рассмотрим перманганатометрическое определение ионов Fe2+.Для этого проводят титрование анализируемой пробы в кислой среде (H2SO4) рабочим раствором KMnO4. Взаимодействие титранта и тируемого вещества описывается реакцией: 5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O (4.51) Запишем полуреакции для титранта KMnO4 и титруемого вещества:
5 Fe2+ - e- = Fe3+; z2=1 (восстановитель) Стехиометрическое число электронов n = 5 – это суммарное число электронов, отданное восстановителем (Fe2+) и принятое окислителем (MnO4-). Составим уравнение Нернста, описывающее потенциал системы после точки эквивалентности, который определяется полуреакцией MnO4- → Mn2+
Данные расчеты являются приблизительными, т.к. не учитывают межионное взаимодействие, поэтому реальное значение потенциалов в системе обычно ниже, а в расчетные формулы вместо концентраций следует подставлять значение активностей ионов (аi). Величина потенциала, учитывающая активности ионов называется формальным потенциалом. Е°'. Как видно из уравнения (4.50), Е = Е°', если [ох] = 1,0 и [red] = 1,0. Формальный потенциал характеризует систему, в которой концентрации всех участников (а не активности) равны 1,0 моль/л. Если эффектом ионной силы можно пренебречь, то Е0' = Е°, иформальный потенциал совпадает со стандартным.
|
||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 781; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

 , (4.48)
, (4.48) (4.49)
(4.49)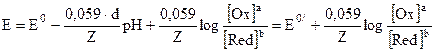 (4.50)
(4.50)
 ; a=1; b=1, d=8 и Z = 5 (4.52)
; a=1; b=1, d=8 и Z = 5 (4.52)


