
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет потенциала в точке эквивалентности и значения константы равновесия
Уравнение окислительно-восстановительной реакции в общем виде можно представить схемой: a red1 + b ox2 = c ox1 + d red2, (4.54) где a, b, с, d – стехиометрические коэффициенты. Окислительно-восстановительные потенциалы пар, участвующих в реакции, определяются уравнением Нернста:
В состоянии равновесия потенциалы обеих пар равны:
Подставляем в соотношение (4.57) уравнения (4.55) и (4.56):
После несложного преобразования (4.58) получаем
По закону действующих масс константа равновесия этой реакции имеет вид следовательно под знаком логарифма находится выражение именно константы равновесия данной реакции, поэтому можно записать:
Тогда для 25 °С получим:
где Уравнение (4.62) показывает, что чем больше разность стандартных потенциалов исходных окислителя и восстановителя, тем больше константа равновесия и, следовательно, тем полнее будет протекать реакция слева направо при прочих равных условиях. Однако большое числовое значение константы равновесия еще не гарантирует высокой скорости реакции. Константа равновесия дает возможность рассчитать концентрации веществ при наступлении равновесия, но не позволяет предвидеть, как скоро оно наступит. Расчет потенциала в точке эквивалентности в первом приближении выполняют по уравнению:
где z1 и z2 – число электронов в соответствующей полуреакции для окислителя и восстановителя, а Например, Тогда Основные виды редоксиметрии и их применение Перманганатометрия Перманганатометрический метод анализа основан на реакции перманганата калия с восстановителями преимущественно в кислой среде, создаваемой H2SO4. Путем прямого титрования определяют восстановители ( железо, олово, уран, оксалаты, нитриты), а обратного титрования – окислители (пиролюзит). Некоторые вещества, не обладающие окислительно-восстановительными свойствами ( катионы кальция, стронция, бария, свинца, цинка), анализируют титрованием по замещению. Метод восстановления в сильнощелочной среде по уравнению МnО4-+ е- = МnО42- используется в анализе отдельных органических соединений.
Титрованный раствор KMnO4 по точной навеске приготовить невозможно, так как в нем всегда содержится некоторое количество МnО2 и другие продукты разложения. Титр раствора перманганата калия устанавливают по безводному оксалату натрия Na2C2O4 или дигидрату щавелевой кислоты Н2С2О4 · 2Н2О. Реакция взаимодействия перманганата калия со щавелевой кислотой относится к типу автокаталитических. Она катализируется ионами Мn2+: 2MnO4-+ 5H2C2O4 + 11H+ = 2Мn2+ + 10СО2 + 8Н2О (4.64) Конец титрования определяют безиндикаторным визуальным способом по появлению слабого розового окрашивания, устойчивого в течении 30сек, у титруемого раствора. При работе с разбавленными растворами применяют редокс-индикаторы, такие, как дифениламинсульфокислота или ферроин (координационное соединение Fe(II) с 1,10-фенантролином). Иодометрия Основу йодометрических методов составляет полуреакция: I2 + 2е- = 2I-; стандартный потенциал которой Растворимость элементарного иода в воде невелика (0,2 г/л или примерно 1·10-3 моль/л), поэтому его титрованные растворы готовят растворением точной навески свободного иода в концентрированном растворе KI, в котором образуется комплексный ион I3-, что существенно увеличивает растворимость иода, не сказываясь практически на величине стандартного потенциала. Титр раствора иода можно устанавливать по As2O3. Методы, основанные на прямом окислении веществ раствором иода (окислитель), иногда называют иодиметрическими, а те, в которых окисляетсяиодид (восстановитель) с последующим титрованием выделившегося иода, – йодометрическими. Иод, выделившийся в результате окисления иодид-иона I-, титруют раствором тиосульфатом натрия: 2S2O32- +I2 = S4O62- + 2I- (4.65) Рабочие растворы тиосульфата натрия готовят из перекристаллизованного препарата Na2S2O3×5Н2О с последующим установлением его точной концентрации по йоду, дихромату калия, металлической меди или другому веществу. Для стабилизации титра раствор Na2S2O3 необходимо выдержать 7-10 дней, в течение которых могут протекать такие реакции, как карбонизация
Na2S2O3 + CO (CO2) → Na2CO3 + NaHCO3 (4.66) и образование Na2SO4 под действием атмосферного кислорода. В дальнейшем концентрация стабилизируется и меняется слабо. При длительном хранении возможно помутнение раствора за счет действия тиобактерий приводящих к выделению коллоидной серы. Такой раствор для анализа не применим. В качестве индикатора в иодометрии используют 0,5% раствор крахмала, образующего с I2 устойчивое соединение, окрашивающее раствор в интенсивно синий цвет. Чувствительность реакции очень высока и позволяет фиксировать концентрацию иода на порядок меньше, чем по его собственной окраске. Йодометрические определения выполняют только на холоду вследствии летучести иода и, кроме того, с повышением температуры существенно уменьшается чувствительность индикаторной иод-крахмальной реакции. Анализ рекомендуется выполнять при рН < 8,0; а разбавленные (0,01 М) растворы титровать в кислой среде при значении рН ≤ 7,0, так как в щелочном растворе образуется гипоиодит (KIO) и некоторые другие нетитруемые продукты реакции: I2 + 2ОН- = IO-+ I- + Н2О (4.67) В сильнокислых растворах возникает опасность окисления I- кислородом воздуха. Метод иодометрии используется для определения восстановителей (соединения As(III), Sb(III), Sn(II), сероводород, органические вещества и др.). Так содержание олова, предварительно восстановленное металлическим свинцом или никелем, находят титрованием его в солянокислой среде по реакции: SnCl+ + I2 + 3С1-= SnCl4 + 2I- (4.68) Анализ выполняют в атмосфере СО2 для предотвращения окисления кислородом воздуха. Для окислителей применяют заместительное титрование, в процессе которого происходит окисление вспомогательного раствора KI до I2, с последующим титрованием выделившегося иода тиосульфатом натрия. Аналогично ведут анализ пероксида водорода, а также неорганических и органических пероксидов, восстанавливаются иодидом в кислой среде: Н2О2 + 2I- + 2Н+ = I2 + 2Н2О (4.69) Основой йодометрического определения кислот, дающего очень хорошие результаты для разбавленных растворов сильных электролитов (10-3 моль/л), является реакция: IO3- + 5I- + 6Н+ = 3I2 + 3Н2O (4.70) Комплексометрический анализ Комплексометрический анализ представляет вид титрования, в основе которого лежит реакция комплексообразования между титрантом и определяемым катионом. Различают два вида комплексометрии: комплексонометрия и меркуриметрию. В комплексонометрии используют в качестве рабочих растворов органические реагенты, называемых комплексонами, с помощью которых определяют более 60-ти ионов. Под комплексонами понимают группу полиаминополикарбоновых кислот и их производные, которые способны с катионами металлов вступать в реакцию с образованием внутрикомплексных соединений (хелатов). Простейшим представителем ряда комплексона является иминодиуксусная кислота, имеющая структуру:
Известны также соединения комплексонов, содержащие гетероатомы (серу, кислород и др.) и, кроме карбоксильной, другие кислотные группы – алкилфосфоновую, алкиларсоновую, оксигруппу и т. п.
Число различных видов комплексонов в настоящее время составляет не одну сотню, однако под термином «комплексонометрия», или «хелатометрия», имеют в виду реакции, протекающие при титровании катионовметаллов, этилендиаминтетрауксусной кислотой (ЭДТУ) или же солями этой кислоты (MenH2Y). Этилендиаминтетрауксусная кислота (H4Y) - четырехпротонная, а ее анион принято обозначать Y4-. При рН 3 - 6 в растворе существуют в основном ионы H2Y2-, при рН > 12 кислота полностью ионизирована. Ниже приведены структурные формулы ЭДТУ и ее двунатриевой соли (ЭДТА). а) Этилендиаминтетрауксусная кислотаЭДТУ или комплексон II (H4Y):
б) Двунатриевая соль этилендиаминтетрауксусной кислоты - ЭДТА (Na2H2Y), известная также под названием комплексон III или трилон Б (название торговой марки реактива) является основным рабочим раствором в комплексонометрии. Структурная формула ее отличается от ЭДТУ тем, что два иона водорода замещены на натрий. Соль легко получается в чистом виде, хорошо растворима, устойчива при хранении.
Титр водного раствора ЭДТА (Nа2Н2Y×2Н2O) устанавливают по ZnCl2, путем растворением точной навески металлического цинка в хлороводородной кислоте, или по сульфату магния. Применяемые для анализа растворы ЭДТА имеют концентрацию 0,01 – 0,05 моль/л, реже - 0,1 моль/л. В своем составе ЭДТА имеет 6 функциональных групп (две аминогруппы и 4-ре карбоксильные), благодаря чему обладает хелатирующей способностью, т.е. образует с ионом металла прочные внутрикомплексные соединения. Например, двухзарядный ион металла Ме2+ замещает в ЭДТА два атома водорода карбоксильных групп и одновременно координационно связывается с атомами азота. Структура такого пятичленного цикла, схема которого приведена ниже, очень устойчива.
Важным свойством комплексона III является отсутствие ступенчатого комплексообразования, поэтому в результате реакции всегда образуются соединения MеY состава 1:1. Отсутствие иных продуктов в растворе является существенным достоинством этого метода и позволяет на практике выполнять определение индивидуальных элементов и их смесей без предварительного разделения компонентов. В качестве примера показаны реакции взаимодействия различных катионов с ЭДТА в растворе. Са2+ + H2Y2- = CaY2- + 2Н+ (4.71) Bi3+ + H2Y2- = BiY- + 2Н+ (4.72) Zr4+ + H2Y2-- = ZrY + 2H+ (4.73) Как видно из уравнений (4.71) – (4.73), независимо от заряда катиона в реакции комплексообразования с ЭДТА принимает участие только один анион и происходит выделение двух ионов водорода. Кроме того, многие малорастворимые вещества с ЭДТА дают водорастворимые устойчивые комплексы, что позволяет их титровать без предварительного перевода в раствор (по точной навеске).
Степень протекания реакции катионов металлов с ЭДТА зависит в значительной мере от кислотности среды, что особенно заметно при определении ионов металлов, комплексы которых сравнительно малоустойчивы. В этом случае титрование возможно в щелочной среде ( Mg2+, Ca2+) или слабокислой (Zn2+, Cd2+, Pb2+ и др.), поэтому анализ большинства катионов выполняют с применением аммиачного буферного раствора. Если устойчивость комплексов очень высока, как например у Fe3+, Zr4+, то можно титровать и в довольно кислом растворе. На рисунке 4.24 показан вид типичной кривой комплексонометрического титрования с использованием ЭДТА в среде аммонийного буфера (0,1 моль/л), построенной в координатах рZn - Vт-та, где рZn = -logC(Zn2+) – показатель концентрации ионов цинка в растворе. Титруемый катион (Zn), взаимодействуя с NH3×H2O, образует аммиачный комплекс (аммиакат), через посредство которого протекает его реакция с ЭДТА: Zn(NH3)n2+ + H2Y2- = ZnY2- + 2NH4+ + (п - 2)NH3
Рис. 4.24 – Кривая титрования 0,01 М Zn(NO3)2 при рН =10 (аммонийный буфер) рабочим 0,01 М раствором Na2H2Y
В области точки эквивалентности (рис. 4.24) происходит резкое изменение концентрации ионов цинка (скачок титрования), которое можно заметить с помощью соответствующих металлохромных индикаторов. Рассмотрим факторы, влияющие на величину скачка титрования. Величина скачка на кривой титрования зависит: от констант устойчивости образующихся комплексов и концентрации реагентов в растворе. На скачке также сказывается температура среды. Если реакция комплексообразования экзотермическая, то устойчивость комплексов с увеличением температуры уменьшается, а если она эндотермическая, то с ростом температуры устойчивость несколько повышается. Суммарный эффект устойчивости комплексов в присутствии «вспомогательного» лиганда (в данном случае аммиака) отражается условной константой устойчивости. Чем меньше условная константа устойчивости, тем меньше скачок титрования. Числовое значение условной константы устойчивости определяется константами устойчивости всех форм комплексов, образующихся в результате титрования при данном значении рН, включая и комплексы определяемого катиона со «вспомогательным» лигандом. В данном случае, чем больше концентрация аммиака и выше устойчивость аммиачных комплексов, тем меньше будет условная константа устойчивости и тем меньше будет скачок титрования. При постоянном значении рН, концентрации буферного раствора и температуры среды расчет равновесных концентраций различных форм комплексных ионов упрощается.
Виды комплексов.
|
||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 1735; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.179.119 (0.04 с.) |
 . (4.55)
. (4.55) ; (4.56)
; (4.56) , (4.57)
, (4.57) =
=  (4.58)
(4.58) . (4.59)
. (4.59) , (4.60)
, (4.60) или
или  . (4.61)
. (4.61) . (4.62)
. (4.62)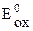 и
и  – стандартный потенциал пары, выступающей в данной реакции в качестве окислителя (
– стандартный потенциал пары, выступающей в данной реакции в качестве окислителя ( , (4. 63)
, (4. 63) и
и  – соответственно их стандартные потенциалы. Для более точного расчета необходимо учесть кислотность среды и активности ионов в растворе, т.е. вычислить значения формальных потенциалов, которые затем подставить в формулу.
– соответственно их стандартные потенциалы. Для более точного расчета необходимо учесть кислотность среды и активности ионов в растворе, т.е. вычислить значения формальных потенциалов, которые затем подставить в формулу.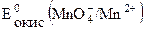 = 1,51В; а
= 1,51В; а  = 0,77В; z1 = 5, z2 = 1.
= 0,77В; z1 = 5, z2 = 1. В.
В. .
.







