
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кривая титрования системы сильное – сильное
Особенность титриметрической системы сильное - сильное заключается в титровании сильного электролита рабочим раствором, в качестве которого также используют сильный электролит. Продукт реакции такой системы – негидролизующаяся соль, поэтому положение точки эквивалентности в ней совпадает с линией нейтральности (рНэкв = 7). Такими свойствами, например, обладает протолитическая пара HCl - NaOH. При этом возможны 2-а случая: а) титрование сильной кислоты рабочим раствором щелочи; б) титрование сильного основания рабочим раствором сильной кислоты. Особенность этой кривой – возможность ее зеркального отображения относительно линий нейтральности и эквивалентности, т.е кривая титрования HCl - NaOH (титрант) преобразуется в кривую титрования NaOH - HCl (титрант). а) титрование сильной кислоты сильным основанием Пусть титруют сильную кислоту сильным основанием, например 0,1 н. HCl – титруемое вещество (X), а 0,1 н. раствор NaOH – титрант (Т). На рисунке 4.14 представлен вид кривой титрования такой системы, точки которой рассчитаны по методике, представленной в разделе 4.8, с применением формул приближенного вычисления рН (таблица 4.4). Рассмотрим ее основные области.
Рисунок 4.14 - Кривая титрования сильной кислоты сильным основанием на примере 0,1 н. раствора HCl, титруемого 0,1 н. раствором NaOH
1. Значение pH титруемого раствора определяется концентрацией исходной сильной кислоты, которое обычно не превышает значения 1–2. Диссоциацию кислоты в титруемом растворе считаем полной, так как концентрации обычно невелики и составляют порядка 0,1 - 0,01 н. 2. После начала титрования и до точки эквивалентности значение pH раствора определяется избытком сильной кислоты HCl в растворе. Соль, образующаяся в процессе реакции с титрантом, не влияет на ход кривой титрования. При титровании сильной кислоты уменьшение концентрации протонов определяется выражением [H+] = Сi(Х), где Сi(Х) – текущая концентрация остатка кислоты с учетом изменения объема раствора. Следовательно значение рН до начала скачка будет изменяться достаточно быстро (отсутствие буферного действия). 3.
Значение рН среды в пределах скачка изменяется от кислой среды (рН < 7) до щелочной (рН > 7), следовательно титровать можно как с фенолфталеином, так и с метиловым оранжевым, рТ которых лежит в области скачка. (рис. 4.14). 4. б) титрование сильного основания сильной кислотой Пусть титруют сильное основание сильной кислотой, например 0,1 н. NaOH – титруемое вещество (X), а 0,1 н. HCl раствор – титрант (Т). Кривая титрования сильного основания сильной кислотой (рис. 4.15)рассчитывается аналогично предыдущей и представляет собой зеркальное отображение кривой титрования сильной кислоты сильным основанием (рис.4.14) относительно линий нейтральности и эквивалентности. Положение скачка и точки эквивалентности обоих кривых – совпадает, как и уравнение Т.Э.: NaOH + HCl = NaCl + H2O. Отсутствие гидролиза и образования буферов выражается в относительно быстром изменении кислотности среды.
Рисунок 4.15 – Кривая титрования сильного основания (0,1н. NaOH) сильной кислотой (0,1н. HCl)
1. Значение pH определяется концентрацией исходного раствора сильного основания, которое обычно составляет 12 – 14. При расчете раствор считаем полностью диссоциированным. 2. После начала титрования и до точки эквивалентности значение pH раствора определяется избытком сильного основания NaOH. При титровании сильного основания уменьшение концентрации гидроксо-групп определяется выражением [ОН-] = Сi(Х), где Сi(Х) – текущая концентрация остатка щелочи с учетом изменения объема раствора. Следовательно значение рН до начала скачка будет изменяться достаточно быстро (отсутствие буферного действия). 3. Среда в точке эквивалентности нейтральная, pH=7 – точка на линии нейтральности. Значение рН среды в пределах скачка изменяется от щелочной (рН > 7) до кислой среды (рН < 7), следовательно титровать можно как с фенолфталеином, так и с метиловым оранжевым, рТ которых лежит в области скачка. (рис. 4.15).
4.
|
||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 267; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.24.209 (0.008 с.) |
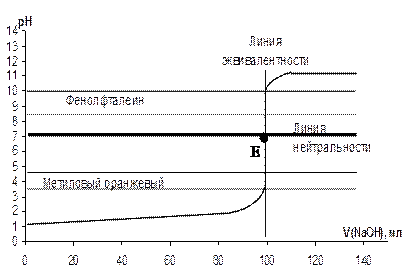
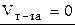 – начальная точка титрования.
– начальная точка титрования. – область до начала скачка.
– область до начала скачка. - область скачка, содержащая Т.Э. Среда в точке эквивалентности нейтральная, pH=7 – точка на линии нейтральности. Уравнение Т.Э. имеет вид: HCl + NaOH = NaCl + H2O.
- область скачка, содержащая Т.Э. Среда в точке эквивалентности нейтральная, pH=7 – точка на линии нейтральности. Уравнение Т.Э. имеет вид: HCl + NaOH = NaCl + H2O. - раствор перетитрован. Значение pH титруемого раствора после Т.Э. определяется концентрацией избытка щелочи С(T), прибавленной сверх стехиометрического количества. Концентрация протонов в растворе убывает в следствии накопления гидроксо-групп, поэтому значение рН быстро возрастают.
- раствор перетитрован. Значение pH титруемого раствора после Т.Э. определяется концентрацией избытка щелочи С(T), прибавленной сверх стехиометрического количества. Концентрация протонов в растворе убывает в следствии накопления гидроксо-групп, поэтому значение рН быстро возрастают.
 - область скачка, содержащая Т.Э.
- область скачка, содержащая Т.Э.


