
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Индикаторные ошибки в кислотно-основном методе титрования.Содержание книги
Поиск на нашем сайте В протолитометрии различают 4 вида индикаторных ошибок: водородная, гидроксильная, кислотная и основная. 1. Водородная (Н+) ошибка возникает при титровании сильных электролитов (сильное – сильное) и обусловлена избытком протонов в растворе. Эта ошибка имеет место, если сильная кислота - недотитрована, а сильное основание – перетитровано. 2. Гидроксильная (ОН–) ошибка также характерна для титрования системы сильное – сильное и возникает при избытке гидроксо - групп в растворе. Сильная кислота при этом будет перетитрована, а сильное основание – недотитровано. 3. Кислотная ошибка проявляется при титровании слабой кислоты сильным основанием, в том случае, когда слабая кислота недотитрована и в растворе избыток протонов. 4. Основная ошибка характеризует систему слабое основание - сильная кислота в момент, когда слабое основание недотитровано, т.е. при избытке в растворе гидроксо-групп. Так как при титровании слабых электролитов в качестве титранта обычно используют сильный электролит (щелочь или кислоту), то в перетитрованном растворе избыток титранта создает погрешность 1-го или 2-го типа: водородную или гидроксильную ошибку. Главным критерием применимости того или иного индикатора является значение индикаторной ошибки, которая не должна превышать 0,5%. Если погрешность выше, то такой индикатор применять нельзя.
Методы и способы титрования. Титр, титр по определяемому веществу
Аналитическая характеристика каждого титриметрического метода включает наиболее существенные его особенности: приготовление и свойства рабочих растворов, виды кривых титрования, погрешности определения, способы индикации точки эквивалентности и практическое применение. На основании этого все методы титрованияклассифицируют по 2-м признакам: типу реакции, лежащей в основе метода и способу проведения анализа. Каждый вид титрования имеет свои особенности и закономерности и может осуществляться различными способами. Как видно из схемы (рис. 4.9), в зависимости от типа реакции, лежащей в основе метода, различают 4-ре вида титрования: Ø кислотно-основное или метод нейтрализации (протолитометрия); Ø окислительно-восстановительное (редоксиметрия); Ø комплексометрическое; Ø осадительное (метод седиментации).
Рисунок 4.9 – Классификация методов титрования в соответствии с типом химической реакции (где L – комплексный ион; МеL – образовавшийся комплекс; А – осаждаемое вещество, В – титрант, АВ – осадок). Способы титрования. Так как напрямую, реакцией с титрантом, можно анализировать далеко не любое вещество, особенно, если оно неустойчиво на воздухе, то для решения подобных задач было разработано несколько приемов (способов) проведения анализа. Они позволяют заменять неустойчивые, в данных условиях соединения, на эквивалентное количество более устойчивого, которое не подвергается гидролизу или окислению. Известны следующие основные способы проведения титриметрического анализа: Ø прямое титрование; Ø реверсивное; Ø обратное титрование или титрование по остатку; Ø косвенное титрование или по замещению (по заместителю). В таблице 4.1 показаны области применения различных способов в зависимости от вида титрования.
Таблица 4.1 – Применение различных видов и способов титрования.
Рассмотрим подробнее суть различных способов титрования. 1. Прямое титрование заключается в непосредственном взаимодействии титранта и титруемого вещества. В процессе титрования к аликвоте или навеске вещества постепенно добавляют раствор титранта, объем которого точно фиксируют в Т. Э.В качестве титранта используют рабочий раствор известной концентрации. Расчет содержания вещества в образце выполняют по закону эквивалентов:
где Концентрацию компонента А в растворе вычисляют по формуле:
где
Метод применяется во всех случаях, когда нет каких-либо ограничений. Например, при анализе кислот, определении жесткости воды.
2. Реверсивное титрование – это разновидность прямого титрования, когда рабочий и титруемый растворы меняют местами. В этом случае для анализаотбирают аликвоты рабочего раствора, а в Т.Э. измеряютизрасходованный натитрование объем анализируемого раствора. Вычисления проводят также, как и в прямом титровании, по формулам (4.2) или (4.3). Метод позволяет ограничить площадь поверхности раствора, контактирующей с воздухом, при стандартизации относительно неустойчивых соединений, как например NaOH.
Титрование по заместителю (косвенное) и титрование по остатку(обратное) основаны на использовании вспомогательного раствора, взаимодействующего с определяемым компонентом. Такой прием позволяет выполнять анализ химически нестойких объектов или же при отсутствии подходящего индикатора.
В косвенном титровании сначала осуществляют реакцию определяемоговещества А со вспомогательным раствором В, а затемтитруют эквивалентное количество образовавшегося продукта реакции С (заместитель). Этот способ можно представить в виде схемы: А + В
Из равенства (4.4) следует, что
Вобратном титровании также сначала протекает реакция между определяемымвеществом А ивзятым в избыткевспомогательным раствором В, но затем титруют остаток не прореагировавшего вспомогательного раствора. Поэтому необходимо точно знать концентрацию вспомогательного раствора В и его объем, взятый для анализа. Определение компонента А выполняется согласно схеме: А + В
Откуда имеем:
Если все вещества взяты в виде растворов, то формула (4.6) примет вид
Если хотя бы одно из веществ взято в сухом виде (известна его масса), то следует воспользоваться выражением (4.6) и записать значение
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 1218; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |


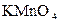 )
)
 и
и  )
)
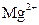
 )
)
 осадок
осадок
 ,
,  ,
,  ;
;  ,
, 
 =
=  (4.1)
(4.1) -количество моль-эквивалентов титранта, вступившего в реакцию с определяемым компонентом А.
-количество моль-эквивалентов титранта, вступившего в реакцию с определяемым компонентом А. (4.2)
(4.2)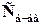 – молярная концентрация эквивалента (нормальность) титруемого раствора (определяемого компонента), моль-экв/л;
– молярная концентрация эквивалента (нормальность) титруемого раствора (определяемого компонента), моль-экв/л;  – объем аликвоты титруемого раствора, мл;
– объем аликвоты титруемого раствора, мл;  – концентрация и
– концентрация и  - объем титранта в точке эквивалентности. При титровании методом отдельных навесок формула (4.2) преобразуется в выражение (4.3):
- объем титранта в точке эквивалентности. При титровании методом отдельных навесок формула (4.2) преобразуется в выражение (4.3): (4.3)
(4.3) С + (т-т), исходя из которой запишем выражение для закона эквивалентов:
С + (т-т), исходя из которой запишем выражение для закона эквивалентов: =
=  . (4.4)
. (4.4) –
–  (4.7)
(4.7) для каждого из веществ индивидуально.
для каждого из веществ индивидуально.


