
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Титр раствора и титр по определяемому веществу.
Концентрацию растворов, применяемых в титриметрии, выражают не только через моль-экв/л (нормальность), но и через титр раствора (
Титр вещества Титр вещества
где Иногда титр для удобства в расчетах выражают в мг/мл. Через простой титр легко рассчитать молярную концентрацию (молярность) или молярную концентрацию эквивалента (нормальность) раствора, подставив туда выражение массы вещества через титр.
Пример. Пусть в растворе соли, объемом 250 см3 содержится 0,5 г Исходя из формул (4.8) и (4.9), Т(Na2CO3) = 0,005/250 =
Титр по определяемому веществу Титр по определяемому веществу
Между титрами Т(В) и m(В) = где V(B) в мл – объем раствора В, пошедший на реакцию (титрование) с веществом А; m(В) – масса вещества реагента В (титранта), m(А) – масса вещества А, эквивалентная массе реагента В в его растворе объемом V(B).
Тогда молярная концентрация эквивалента (нормальность) раствора В через значение
Если для рабочего раствора В известно значение
Классификация растворов, применяемых для титрования И способы их приготовления. В титриметрии используют растворы, концентрация которых установлена каким-либо способом с высокой степенью точности. Такие растворы называют стандартными титрованными или просто титрованными. Растворы классифицируют по назначению и по способу установления их концентрации. По назначению их условно делят на рабочие растворы и растворы стандартов (первичные и вторичные). Рабочими называют растворы, которые используются непосредственно в анализе при определении содержания вещества. Если рабочий раствор не относится к стандартным, то его необходимо отстандартизировать непосредственно перед выполнением анализа, так как концентрация в процессе хранения могла существенно измениться. Точную концентрацию рабочего раствора находят путем титрования стандартного раствора или установочных веществ (метод точных навесок). Это касается, например, таких рабочих растворов, как: NaOH, Na2S2O3×5H2O. Под стандартным раствором понимают такой титрованный раствор, который устойчиво сохраняет свою концентрацию при длительном хранении. Основное назначениестандартных растворов - определение точной концентрации рабочих и иных растворов, применяемых в титровании. Процесс установления точной концентрации раствора путем его титрования по стандарту называется стандартизацией. По способу определения концентрации различают первичные стандарты или растворы с приготовленным титром и стандартизированные растворы. Стандартизированные растворы - это такие растворы, концентрация которых устанавливается по стандарту и заранее не может быть точно определена. К ним относятся растворы кислот, щелочей, гидролизующихся и гигроскопичных солей, а также веществ, которые могут реагировать с атмосферным кислородом и углекислотой. Известно множествоспособовприготовления стандартизированных растворов. Наиболее часто для этой цели применяют: приготовление по приближенной навеске (щелочи, соли), методы разбавления или смешения растворов (кислоты, соли), методы ионного обмена (растворы солей).
Стандартные растворыклассифицируют по способу определения их концентрации. Различают: первичные стандарты или растворы с приготовленным титром и вторичные стандарты - растворы с установленным титром. Первичные стандарты - это растворы, которые готовят либо по точной навеске вещества (рис. 4.10), либо путем разведения специально приготовленных стандартизированных реагентов – фиксаналов (рис. 4.11). Фиксанал представляет собой стеклянную запаянную ампулу, выпускаемую промышленностью и содержащую строго нормированное количество реагента, обычно рассчитанного на 1 л 0,1 н. раствора. Приготовление раствора по точной навеске начинают с расчета ее массы по заданной концентрации (титру или нормальности) и объему колбы. Навеску стандартного вещества взвешивают на аналитических весах с точностью до 1×10-4 г и количественно переносят в мерную колбу, где ее растворяют при перемешивании (рис. 4.10).
Рисунок 4.10 – Порядок операций при приготовлении раствора первичного стандарта по точной навеске: 1 – мерная колба Мора; 2 – воронка; 3 – бюкс с навеской вещества; 4 – промывалка с дистиллированной водой; 5 – пипетка или капельница. а – перенос навески вещества в мерную колбу; б – ополаскивание воронки; в – доведение объема раствора стандарта до метки.
Этим методом обычно готовят растворы солей, таких как бура (Na2B4O7×10H2O), K2Cr2O7. Количество вещества в растворе находят или по значению точно взятой массы навески (при ее переносе необходимо тщательно промыть бюкс), или рассчитывают методом разности, определяя точную массу бюкса сначала с навеской, а затем – пустого, уже после переноса вещества в колбу. В случае необходимости - концентрацию раствора заново пересчитывают с учетом фактически взятой массы навески. Порядок приготовления раствора методом разведения из фиксанала показан на рисунке 4.11. Чтобы стандарт, полученный этим методом, был качественным и отвечал всем требованиям, необходимо исключить потери вещества при вскрытии ампулы и переносе его в колбу, а также следить, чтобы осколки ампулы не попали в раствор. Это во многом зависит от правильности обращения с ампулой.
Рисунок 4.11 – Способ приготовления растворов первичного стандарта методом разведения из фиксанала: 1 – мерная колба Мора на 1л; 2 – нижний боек; 3 – воронка; 4 – ампула фиксанала; 5 – верхний боек.
Перед использованием, ампулу следует ополоснуть дистиллированной водой и только затем ее вскрывать специальным бойком. Сразу же после переноса вещества в колбу, нужно тщательно промыть ампулу дистиллированной водой, не менее, чем 6-ти кратным ее объемом. Этот метод приготовления первичного стандарта проще, чем по точным навескам, но уступает ему в точности. Его используют не только для получения растворов солей, но и различных кислот. Так как для приготовления раствора первичного стандарта пригодны только точная мерная посуда и аналитические весы, то и к веществам, применяемым для этой цели, предъявляют ряд обязательных требований. В качестве первичного стандарта можно использовать только такие реактивы, которые характеризуются:
Ø высокой чистотой (обычно не хуже, чем 99,99 – 99,999% - квалификации ч.д.а. и о.с.ч.); Ø точным соответствием формульному составу и относительно высокой молекулярной массой; Ø устойчивостью при хранении как в твердом виде, так и в растворе (отсутствие процессов гидратации, гидролиза, окисления и карбонизации); Ø простотой в приготовлении и хорошей растворимостью; Ø необратимостью реакции при стандартизации, селективностью; Ø возможностью точной фиксации Т. Э. каким-либо методом. Вторичным стандартом называют такие стандартизированные растворы, которые устойчивы при хранении и могут быть использованы для стандартизации других растворов. Вторичные стандарты готовят как растворы приблизительной концентрации любым известным методом, а перед употреблением - определяют их точную концентрацию путем стандартизациипо первичному стандарту. Поэтому при приготовлении вторичных стандартов не требуется высокая точность измерения массы вещества или объема раствора, как в случае первичных стандартов. Для этой цели вполне пригодны технохимические весы и неточная мерная посуда (цилиндры, мензурки, градуированные пробирки). Примером раствора, обладающего свойствами вторичного стандарта, является соляная кислота. Ее разбавленные растворы могут храниться длительное время, до 1-го месяца и более, без заметного изменения концентрации. Бура, используемая в протолитометрии для стандартизации HCl, относится к первичным стандартам и готовится по точной навеске. Тогда, как рабочий раствор NaOH – свойствами стандарта не обладает вообще и его концентрацию приходится устанавливать заново при каждом использовании.
|
|||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 3767; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.187.233 (0.014 с.) |
 ) и титр по определяемому веществу (
) и титр по определяемому веществу ( ). Эти концентрации более удобны, так как непосредственно позволяют вычислять массу определяемого компонента по результатам титрования. Формулы, приведенные в стандартных методиках титриметрического анализа, предназначенных для большого числа однотипных измерений, содержат значение титра по определяемому веществу
). Эти концентрации более удобны, так как непосредственно позволяют вычислять массу определяемого компонента по результатам титрования. Формулы, приведенные в стандартных методиках титриметрического анализа, предназначенных для большого числа однотипных измерений, содержат значение титра по определяемому веществу  .
. или простой
или простой =
=  (4.8)
(4.8) – масса вещества А (г) в растворе с объемом
– масса вещества А (г) в растворе с объемом 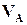 (мл),
(мл),  и
и  (4.9)
(4.9) . Определить титр и нормальность такого раствора.
. Определить титр и нормальность такого раствора. (г/мл), а нормальность:
(г/мл), а нормальность:  =
= 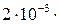 1000/53 =
1000/53 =  (моль-экв/л), где 53 – молярная масса эквивалента
(моль-экв/л), где 53 – молярная масса эквивалента 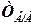 (условный)
(условный) (4.10)
(4.10) и m(А) =
и m(А) =  ,
, или
или  (4.11)
(4.11)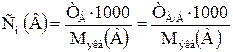 (4.12)
(4.12) легко вычисляется по объему раствора титранта
легко вычисляется по объему раствора титранта  , израсходованному на титрование аликвоты
, израсходованному на титрование аликвоты  :
: (4.13)
(4.13)




