
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Решение уравнения Шредингера и дискретность энергетических уровней электрона в атоме.
Состояние электрона в атоме водорода описывается волновой функцией y, удовлетворяющей стационарному уравнение Шредингера. Решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Возможные значения Е1, Е2, Е3…, показаны на рис.23.2 в виде горизонтальных прямых. Самый нижний уровень Е1, отвечающий минимальной возможной энергии, — основной, все остальные (Еn > Е1, n = 2, 3,...) — возбужденные. Из рисунка следует, что по мере роста главного квантового числа n энергетические уровни располагаются теснее и при n = ¥ E¥ = 0. При Е > 0 движение электрона является свободным; область непрерывного спектра Е > 0 (заштрихована на рис. 23.2) соответствует ионизованному атому. Собственные значения оператора квадрата момента импульса равнs
где l -квантовое число, называемое азимутальным. Модуль момента импульса может иметь лишь дискретные значения, определяемые формулой
Оператор проекции момента импульса на ось OZ
где m – магнитное квантовое число. Таким образом,магнитное квантовое число m определяет проекцию момента импульса электрона на заданное направление. Момент импульса системы, состоящей из нескольких микрочастиц, равен сумме моментов отдельных частиц. Суммарный момент, как и всякий момент, определяется
где l – азимутальное квантовое число результирующего момента. Расщепление спектральных линий называется тонкой структурой. Для объяснения тонкой структуры спектральных линий, американские физики Д. Уленбек и С. Гаудсмит предположили, что у электрона помимо момента импульса L и соответствующей ему проекции момента импульса на ось OZ Lz имеется собственный механический момент импульса Ls, называемый спином электрона. Спин электрона (и всех других микрочастиц) — квантовая величина, у нее нет классического аналога; это внутреннее неотъемлемое свойство электрона, подобное его заряду и массе. Если электрону приписывается собственный механический момент импульса (спин) Ls то ему соответствует собственный магнитный момент Lsz. Согласно общим выводам квантовой механики, спин квантуется по закону:
где s-спиновое квантовое число.
По аналогии с орбитальным моментом импульса, проекция Lsz спина квантуется так, что векторLs может принимать 2s+1 ориентации. Проекция спина на направление внешнего магнитного поля, являясь квантованной величиной, определяется выражением:
где ms — магнитное спиновое квантовое число; оно может иметь только два значения: тs=±1/2. Таким образом, экспериментальные данные привели к необходимости характеризовать электроны (и микрочастицы вообще) добавочной внутренней степенью свободы. Поэтому для полного описания состояния электрона в атоме необходимо наряду с главным, орбитальным и магнитным квантовыми числами задавать еще магнитное спиновое квантовое число. Решение задачи об энергетических уровнях электрона для атома водородоподобных систем сводится к задаче о движении электрона в кулоновском поле ядра. Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze
где r – расстояние между электроном и ядром. Состояние электрона в атоме водорода описывается волновой функцией, удовлетворяющей стационарному уравнению Шредингера:
где m – масса электрона, Е - полная энергия электрона в атоме, е – заряд электрона. Данное уравнение имеет решение, удовлетворяющее стандартным условиям, в следующих случаях: 1) при любых положительных значениях E; 2) при дискретных отрицательных значениях энергии, равных
Случай Собственные функции уравнения (23.5.8), представленные в сферической системе координат, содержат три целочисленных параметра: главное число n, орбитальное число l и магнитное число m
Главное число n определяет энергетический уровень электрона в атоме в соответствии с формулой (23.5.9) и может принимать любые положительные целочисленные значения.
Орбитальное число l определяет орбитальный момент импульса электрона. Согласно законам квантовой механики момент импульса квантуется по правилу
При заданном n орбитальное число может принимать значения
Магнитное число m определяет ориентацию орбитального момента в пространстве. Согласно законам квантовой механики величина проекции момента на некоторое направление z принимает дискретные значения
где m – магнитное квантовое число, которое при заданном l может принимать значения
Таким образом, вектор момента импульса электрона в атоме может иметь в пространстве Квантовые числа n и l характеризуют размер и форму электронного облака, а квантовое число m l характеризует ориентацию электронного облака в пространстве. Согласно (23.5.9) энергия электрона зависит только от главного квантового числа n. Каждому собственному значению энергии Состояния с одинаковой энергией называются вырожденными, а число различных состояний с каким-либо значением энергии называется кратностью вырождения соответствующего энергетического уровня. Кратность вырождения энергетических уровней легко вычисляется путем подсчета возможных значений l и m. Каждому значению квантового числа l соответствует
В атомной физике применяется условное обозначение состояний электрона с различными значениями момента импульса. Электрон, находящийся в состоянии с 1 s, 2 s, 2 p, 3 s, 3 p, 3 d
Испускание и поглощение света происходит при переходах электрона с одного уровня на другой. В квантовой механике доказывается, что для орбитального квантового числа имеется правило отбора
Это означает, что возможны только такие переходы, при которых l меняется на единицу. Правило обусловлено тем, что фотон обладает собственным моментом импульса (спином s). Его величина вычисляется по общему правилу (23.5.10), где вместо l следует использовать Учитывая число возможных состояний, соответствующих данному n, и правило отбора, рассмотрим спектральные линии атома водорода: серии Лаймана соответствуют переходы:
серии Бальмера соответствуют переходы:
Переход электрона из основного состояния в возбужденное обусловлен увеличением энергии атома и может происходить только при сообщении атому энергии извне., например, за счет поглощения атомом фотона.
Рентгеновские спектры
Самым распространенным источником рентгеновского излучения является рентгеновская трубка, в которой сильно ускоренные электрическим полем электроны бомбардируют анод. При торможении электронов возникает рентгеновское излучение. Спектральный состав рентгеновского излучения представляет собой наложение сплошного спектра, ограниченного со стороны коротких волн граничной длиной Сплошной спектр обусловлен излучением электронов при их торможении. Поэтому его называют тормозным излучением. Максимальная энергия кванта тормозного излучения соответствует случаю, когда вся кинетическая энергия электрона переходит в энергию рентгеновского фотона, т.е.
где U – ускоряющая разность потенциалов рентгеновской трубки. Отсюда граничная длина волны
Измерив коротковолновую границу тормозного излучения, можно определить постоянную Планка. Из всех методов определения При достаточно большой энергии электронов на фоне сплошного спектра появляются отдельные резкие линии. Линейчатый спектр определяется только материалом анода, поэтому данное излучение называется характеристическим излучением. Характеристические спектры отличается заметной простотой. Они состоят из нескольких серий, обозначаемых буквами K, L, M, N и O. Каждая серия насчитывает небольшое число линий, обозначаемых в порядке возрастания частоты индексами a, b, g … ( Схема возникновения рентгеновских спектров дана на рис. Возбуждение атома состоит в удалении одного из внутренних электронов. Если вырывается один из двух электронов K -слоя, то освободившееся место может быть занято электроном из какого-либо внешнего слоя (L, M, N и т.д.). При этом возникает K -серия. Аналогично возникают и другие серии, наблюдаемые, впрочем, только для тяжелых элементов. Серия K обязательно сопровождается остальными сериями, так как при испускании ее линий освобождаются уровни в слоях L, M и т.д., которые будут в свою очередь заполнятся электронами из более высоких слоев.
Исследуя рентгеновские спектры элементов, Г. Мозли установил соотношение, называемое законом Мозли
где w – частота линии характеристического рентгеновского излучения, R – постоянная Ридберга, Закон Мозли позволяет по измеренной длине волны рентгеновских линий точно установить атомный номер данного элемента; этот закон сыграл большую роль при размещении элементов в периодической таблице.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-30; просмотров: 391; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.131.110.169 (0.029 с.) |
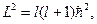 (l=0,1,2,….)
(l=0,1,2,….)
 , (l=0,1,2,….)
, (l=0,1,2,….)
 , (m=0,±1,±2,….)
, (m=0,±1,±2,….)


 (23.5.7)
(23.5.7) (23.5.8)
(23.5.8) . (23.5.9)
. (23.5.9) соответствует электрону, пролетающему вблизи ядра, т.е. свободному электрону. Случай
соответствует электрону, пролетающему вблизи ядра, т.е. свободному электрону. Случай  соответствует электрону, движущемуся вблизи ядра, т.е. связанному электрону. Самый нижний уровень
соответствует электрону, движущемуся вблизи ядра, т.е. связанному электрону. Самый нижний уровень  , отвечающий минимально возможной энергии, называется основным, все остальные – возбужденными. Таким образом, квантование энергии атома является следствием теории, в отличие от теории Бора, в которой квантование вводилось как постулат.
, отвечающий минимально возможной энергии, называется основным, все остальные – возбужденными. Таким образом, квантование энергии атома является следствием теории, в отличие от теории Бора, в которой квантование вводилось как постулат. .
. . (23.5.10)
. (23.5.10) . (23.5.11)
. (23.5.11)
 .
. возможных ориентаций.
возможных ориентаций. (кроме
(кроме  , отличающихся значениями квантовых чисел l и m. Это означает, что атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях.
, отличающихся значениями квантовых чисел l и m. Это означает, что атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. . (23.5.12)
. (23.5.12) называется s -электроном (соответствующее состояние – s -состоянием), с
называется s -электроном (соответствующее состояние – s -состоянием), с  – p -электроном, с
– p -электроном, с 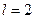 – d -электроном, с
– d -электроном, с  – f -электроном и далее по алфавиту. Значение главного квантового числа указывается перед условным обозначением орбитального числа l. Поскольку l всегда меньше n, возможны следующие состояния электрона:
– f -электроном и далее по алфавиту. Значение главного квантового числа указывается перед условным обозначением орбитального числа l. Поскольку l всегда меньше n, возможны следующие состояния электрона: . (23.5.13)
. (23.5.13) . Данное значение определяет максимальную величину проекции спина на избранное направление. Испускание или поглощение фотона, согласно закону сохранения момента импульса, приводит к изменению момента импульса атома, согласно с правилом (23.5.13).
. Данное значение определяет максимальную величину проекции спина на избранное направление. Испускание или поглощение фотона, согласно закону сохранения момента импульса, приводит к изменению момента импульса атома, согласно с правилом (23.5.13). ;
; и
и  ,
, , и линейчатого спектра – совокупности отдельных линий на фоне сплошного спектра.
, и линейчатого спектра – совокупности отдельных линий на фоне сплошного спектра. ,
, . (23.6.1)
. (23.6.1) данный метод считается самым точным.
данный метод считается самым точным. ,
,  ,
,  , …;
, …;  ,
,  ,
,  , … и т.д.). Спектры разных элементов имеют сходный характер. При увеличении атомного номера Z весь рентгеновский спектр целиком смещается в коротковолновую часть, не меняя своей структуры (рис.). Это объясняется тем, что рентгеновские спектры возникают при переходах внутренних электронов, которые для разных атомов являются сходными.
, … и т.д.). Спектры разных элементов имеют сходный характер. При увеличении атомного номера Z весь рентгеновский спектр целиком смещается в коротковолновую часть, не меняя своей структуры (рис.). Это объясняется тем, что рентгеновские спектры возникают при переходах внутренних электронов, которые для разных атомов являются сходными. , (23.6.2)
, (23.6.2) (определяет рентгеновскую серию),
(определяет рентгеновскую серию),  (определяет линию соответствующей серии), s – постоянная экранирования.
(определяет линию соответствующей серии), s – постоянная экранирования.


