Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение состояния неидеального газаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Простая и удобная модель идеального газа применима в основном к разреженным газам, что соответствует малой плотности вещества. При больших давлениях и низких температурах возникают значительные отклонения от уравнения Клапейрона-Менделеева (2.8), что указывает на несоответствие модели идеального газа его реальному состоянию. Это означает, что уравнение состояния следует видоизменить, причем в его новом виде надо учесть отличие реальных молекул газа от модели невзаимодействующих материальных точек. Прежде всего нужно учесть, что молекулы занимают вполне определенный объем в пространстве. Следовательно, область пространства, доступная для движения реальных частиц газа, не равна геометрическому объему, занимаемому газом, а меньше его на величину собственного объема молекул. Это обстоятельство легко учесть, если вместо геометрического объема теперь писать V ‑ b, где b — константа, характеризующая объем, занимаемый молекулами данного газа. Далее необходимо заметить, что между реальными молекулами, имеющими сложную внутреннюю структуру, существуют силы взаимодействия. Эти силы имеют характер притяжения на сравнительно больших расстояниях и отталкивания на малых расстояниях. Вообще говоря, эти силы проявляются лишь при достаточном сближении молекул, поэтому в разреженных газах их можно не учитывать. Однако при низких температурах, когда энергия теплового движения молекул мала, и при больших давлениях, когда плотность газа возрастает, силы взаимодействия между молекулами начинают играть значительную роль. Макроскопически они проявляются в реальном газе как внутреннее давление, дополнительное к тому, которое обусловлено столкновениями молекул. Это дополнительное давление обусловлено взаимодействием молекул. Поскольку во взаимодействии принимают участие две группы молекул, число каждой из которых пропорционально плотности газа, то поправка к давлению пропорциональна квадрату плотности, то есть обратна пропорциональна второй степени геометрического объема, занимаемого газом. Таким образом, видоизмененное уравнение состояния принимает вид:
где a — другая константа, специфическая для данного газа и учитывающая характер сил взаимодействия между его молекулами. Уравнение (2.45) носит название уравнения Ван-дер-Ваальса. Когда объем газа становится достаточно большим, т. е., газ разрежен, поправками, связанными с отклонениями от идеальности, можно пренебречь и уравнение Ван-дер-Ваальса (2.45) переходит в уравнение Клапейрона-Менделеева(2.8).
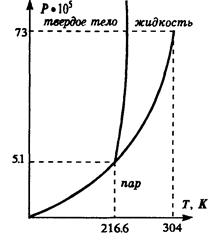
Уравнение Ван-дер-Ваальса по сравнению с уравнением состояния идеального газа содержит ряд особенностей, отвечающих качественно новому поведению реального газа в области низких температур и больших плотностей. Как можно видеть из выражения (2.45), уравнение Ван-дер-Ваальса есть уравнение третьей степени относительно объема. Это означает, что при фиксированных температуре и давлении состояние газа может характеризоваться либо одним, либо тремя значениями V. На рис. изображены изотермы, соответствующие уравнению (2.45). При высоких температурах изотермы представляют собой кривые, характерные для идеального газа. При понижении температуры до определенной величины, которая называется критической, появляется характерный перегиб, ниже которого каждому значению давления отвечают три значения объема газа. Поэтому при данном давлении вещество может находиться в одном из трех возможных состояний или фаз. Состояние с минимальным объемом отвечает большей плотности вещества та. соответствует конденсации газа в жидкое состояние — жидкой фазе. Состоянию с максимально возможным объемом отвечает газообразное состояние вещества. Промежуточное значение объема соответствует неустойчивому состоянию — его называют переохлажденный пар или перегретая жидкость. В этой области небольшие изменения давления вызывают немедленный переход вещества в одно из стабильных состояний. На рис. область существования неустойчивых состояний заштрихована. Она отделяет области существования жидкой и газообразной фаз вещества. Таким образом, важным следствием уравнения состояния неидеально газа является возможность фазового перехода вещества из одного состояния в другое. Кривые на диаграммах P, V или V, T, отделяющие области существования разных фаз, — это кривые фазового равновесия. Они показывают, при каких значениях параметров вещество может существовать в одном из состояний — твердом, жидком либо газообразном.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 654; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.189.143.150 (0.01 с.) |

 , (2.45)
, (2.45)