
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесные процессы в идеальном газеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Если макроскопические параметры системы имеют одинаковые значения во всем объеме, занимаемом системой, и не изменяются с течением времени, то состояние системы является равновесным. Последовательный переход системы из одного равновесного состояния в другое, совершаемый достаточно медленно, так, что в любой заданный момент времени систему можно характеризовать определенными равновесными значениями термодинамических параметров: давления, температуры или объема, называется равновесным процессом. Равновесный процесс представляет собой приближенную модель реального термодинамического процесса. Рассмотрим, например, сжатие газа поршнем в закрытом сосуде. Если поршень вдвигать достаточно быстро, то давление поршня на газ не будет успевать распространяться по всему объему, занятому газом. Давление газа на поршень в каждый момент времени будет больше, чем давление газа на стенки сосуда. Состояние газа в этом случае нельзя характеризовать определенной величиной давления, оно будет существенно неравновесным. Со временем давление перераспределится по всему объему и состояние газа станет равновесным с новым значением давления. Время установления нового состояния равновесия газа определяется его плотностью и температурой. Процесс установления термодинамического равновесия в системе носит название релаксационного процесса, а время установления равновесия — времени релаксации. В случае, когда газ под действием поршня сжимается достаточно медленно, давление успевает равномерно распределиться по всему объему, и в газе в любой заданный момент времени устанавливается равновесие. Таким образом, при медленном движении поршня газ проходит последовательно через ряд равновесных состояний, и процесс термодинамически равновесный. Для того чтобы процесс был равновесным, очевидно, необходимо, чтобы время релаксации в системе было меньше времени, в течение которого система подвергается внешнему возмущению. Рассмотрим ряд равновесных процессов в идеальном газе, имеющих важное значение в термодинамике. При равновесных процессах термодинамические параметры P, V и T в каждый момент времени связаны между собой уравнением состояния (2.8). 1) Изотермический процесс. При изотермическом процессе температура газа остается постоянной в течение всего процесса. Уравнение состояния газа в этом случае имеет вид:
При заданной температуре состояние газа изображается точкой на плоскости, где по осям отложены давление и объем. Последовательность таких точек образует кривую, представляющую изотермический процесс. В случае изотермического процесса кривая является гиперболой и называется изотермой. Разным температурам газа соответствуют различные изотермы. Вычислим работу, производимую газом при изотермическом процессе. Поскольку температура газа остается постоянной dT = 0, при термодинамическом процессе не изменяется внутренняя энергия газа, dE =0, т.е. все подводимое в систему тепло расходуется только на совершение механической работы dQ = PdV. Таким образом,
При изотермическом сжатии газа механическая работа, совершаемая над системой, переходит в тепловую энергию окружающих тел. 2) Изобарический процесс. Этот термодинамический процесс происходит при постоянном давлении. Ему соответствуют на диаграмме P, V горизонтальные прямые — изобары, определяемые уравнением состояния:
Работа при изобарическом процессе пропорциональна разности объемов газа в начальном и конечном состояниях:
3) Изохорический процесс. Зависимость давления от температуры при постоянном объеме представляет собой в координатах P, V вертикальную прямую, называемую изохорой. Поскольку при этом процессе dV = 0, работа равна нулю. 4) Адиабатический процесс происходит в системе без теплообмена с окружающей средой, т. е. dQ = 0. Из первого начала термодинамики (2.32) следует, что при таком процессе dE = ‑ Pd V, т. е. изменение внутренней энергии системы происходит только за счет совершения работы. Выразим изменение внутренней энергии через теплоемкость при постоянном объеме согласно формуле (3.34): dE = v·CV·dT. Тогда v·CV·dT = ‑ PdV. (2.41) Отсюда следует, что при адиабатическом расширении газа dV > 0, dT < 0, и газ охлаждается. При сжатии газа, наоборот, происходит его нагревание и соответственно увеличение внутренней энергии. Разделив выражение (2.41) соответственно на правую и левую части уравнения состояния v·R·T = P·V, интегрируя это соотношение, получим
Наконец, воспользовавшись связью между CP и CV (2. 36) в виде R = СP ‑ CV и вводя определенную ранее характерную для газа величину
Полученное уравнение называется уравнением адиабаты. На плоскости P, V она изображается кривой, которая спадает более круто, чем изотерма (γ > 1). Работа при адиабатическом процессе пропорциональна изменению температур газа в начальном и конечном состояниях:
Все указанные процессы можно рассматривать как частные случаи общего более сложного процесса, при котором давление и объем связаны уравнением
При n = 0 уравнение описывает изобару, при n = 1 — изотерму, при n = γ —адиабату, а при n = ∞ — изохору. Реальный неидеализированный процесс соответствует промежуточным значениям показателя степени в уравнении (2.44).
|
||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 629; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.68.161 (0.006 с.) |

 . (2.37)
. (2.37) . (2.38)
. (2.38) . (2.39)
. (2.39) . (2.40)
. (2.40)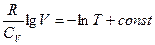
 , получим окончательное соотношение между давлением и объемом идеального газа при адиабатическом процессе
, получим окончательное соотношение между давлением и объемом идеального газа при адиабатическом процессе . (2.42)
. (2.42)
 . (2.43)
. (2.43) . (2.44)
. (2.44)


