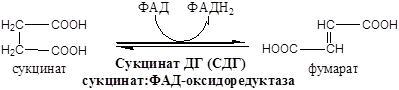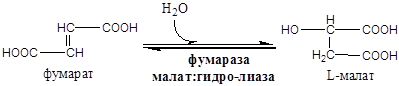Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энзимодиагностика: классификация ферментов клетки, крови в энзимодиагностике, диагностическое значение, применение в педиатрииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Энзимодиагностика – методы диагностики болезней, патологических состояний и процессов, основанные на определении активности ферментов в биологических жидкостях. Классификация ферментов плазмы крови по происхождению: 1) Секреторные ферменты - секретируются определенными органами в плазму крови, где и выполняют свою функцию. Например: ЛПЛ, ЛХАТ, ферменты свертывающей и противосвертывающей системы крови; 2) Экскреторные ферменты - синтезируются в железах ЖКТ, выделяются в просвет ЖКТ, где обеспечивают процесс пищеварения. В кровь эти ферменты попадают при повреждении желез. Например, при панкреатите в крови обнаруживается панкреатическая липаза, амилаза, трипсин и т.д., при воспалении слюнных желез - амилаза слюны. 3) Клеточные ферменты - функционируют только внутри клеток, в плазму крови они попадают во время повреждения (под действием медиаторов воспаления и т.д.) и гибели клеток (при некрозе). К ним относятся общие, органо- и органеллоспецифические ферменты. За счет естественной гибели клеток клеточные ферменты имеют в плазме крови постоянно низкую активность. При поражении органа происходит значительный выход ферментов из его клеток и многократное увеличение активности этих ферментов в плазме крови. Ферменты клетки: 1) Аминотрансферазы. Локализуются в митохондриях, обеспечивают взаимопревращения аминокислот и кетокислот: АК1 + КК2 ↔ КК1 + АК2. a. АСТ: асп+α-КГ ↔ ЩУК+глу. АСТ много в миокарде, по убыванию меньше в печени, скелетной мускулатуре, ЦНС, почках, семенниках. b. АЛТ: ала+α-КГ ↔ ПВК+глу. АЛТ много в печени, поджелудочной железе, миокарде, скелетной мускулатуре. Активность обеих трансаминаз в сыворотке крови возрастает в десятки раз при инфаркте миокарда (АСТ>АЛТ), при остром инфекционном гепатите (АЛТ>АСТ), а также при циррозе печени и мышечной дистрофии. 2) ЛДГ и КК. Относятся к некротическим ферментным методам. a. ЛДГ. Локализуется в цитозоле, обеспечивает взаимопревращения ПВК и лактата. ПВК+ НАДН2 ↔ лактат + НАД+. ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках. ЛДГ4 ЛДГ5 - в скелетных мышцах и печени. При инфаркте миокарда в сыворотке крови резко повышается активность ЛДГ1 и ЛДГ2, а при поражениях скелетной мускулатуры и печени повышается активность ЛДГ4 ЛДГ5. b. КК. Локализуется в цитозоле, митохондриях, миофибриллах. Креатин + АТФ ↔ креатинфосфат + АДФ. Изофермент КК-ВВ находиться преимущественно в головном мозге МВ – в миокарде ММ – в скелетных мышцах. В сыворотке крови КК-ММ повышается при повреждении скелетных мышц, КК-МВ - при инфаркте миокарда. КК-ВВ не проходит гематоэнцефалический барьер и не имеет значения для диагностики патологий ЦНС. Диагностическое значение: В сыворотке крови повышена активность амилазы - острый панкреатит, киста поджелудочной железы; Определение активности ферментов с диагностической целью проводят также в моче, слюне, ликворе и биоптатах органов и тканей. Нормальные значения активности ферментов у детей отличаются от нормальных значений у взрослых. 11. Биохимические основы энзимотерапии, применение ферментов в энзимотеравии (примеры) Энзимотерапия – применение ферментов животного, бактериального или растительного происхождения и регуляторов активности ферментов с лечебной целью. 1) Протеолитические ферменты применяются при нарушении пищеварения. Пример: a. Экстракты слизистой оболочки желудка, основным действующим веществом которых является пепсин. Их в основном используют для коррекции секреторной дисфункции желудка. b. Панкреатические энзимы, представленные амилазой, липазой, трипсином и химотрипсином. Их используются для коррекции нарушений процесса пищеварения, а также для регуляции функций поджелудочной железы. c. Комбинированные ферменты, содержащие панкреатин в комбинации с компонентами желчи, гемицеллюлозой. Их назначают при недостаточной внешнесекреторной функции поджелудочной железы в сочетании с патологией печени, желчевыводящей системы, при нарушении жевательной функции, малоподвижном образе жизни, кратковременных погрешностях в еде. d. Растительные энзимы, представленные папаином, грибковой амилазой, протеазой, липазой и др. ферментами. Папаин и протеазы гидролизируют белки, грибковая амилаза - углеводы, липаза - жиры. e. Дисахаридазы. 2) Протеолитические препараты применяют местно, в виде аппликаций или орошений, при первичной обработке ран и ожогов. Гидролизуя белки некротизированных тканей, ферменты способствуют очищению раны, уменьшению воспаления и ускорению заживления. Пример: a. Коллагеназа вызывает деструкцию коллагена при этом жизнеспособные мышцы, грануляционная ткань и эпителий остаются интактными. При гнойных ранах коллагеназа способствует быстрому очищению от нежизнеспособных тканей и экссудата, более раннему появлению грануляционной ткани и эпителизации, предупреждает развитие грубых рубцов, способствует сохранению функции суставов. b. Гиалуронидазы – ферменты, специфическим субстратом которых является гиалуронованная кислота, основа межклеточного матрикса соединительной ткани. Показателями к их применению являются рубцы после ожогов и операций, гематомы, контрактуры суставов и т.д. Лечебный эффект проявляется размягчением рубцов, рассасыванием гематом, появлением подвижности в суставах. c. Протеолитические ферменты применяют для предотвращения и лечения тромбозов, эмболии, инфаркта миокарда, закупорки сосудов сетчатки глаза. d. Нуклеазы (ДНК-аза, РНК-аза) используют при лечении некоторых вирусных заболеваний. Фермент разрушает ДНК вируса, не повреждая вместе с тем ДНК клеток макроорганизма. e. Бактериолитические ферменты. Препарат обладает наибольшей бактерицидной активностью по отношению к грамположительным бактериям: стафилакоккам, стрептококкам, а также менингококкам, гонококкам. Особенность, препарат показывает высокую бактерицидную эффективность вне зависимости от устойчивости бактерий к действию антибиотиков. Энзимотерапию применяют в случае недостаточности ферментов, либо вместе с другими препаратами. Цикл Кребса - схема реакций, ферменты, коферменты, энергетический баланс одного оборота. Тканевые особенности в детском возрасте, Регуляция. Цикл Кребса. ЩУКа "съела" ацетат, Получается цитрат. Через cis-аконитат Будет он - изоцитрат. Водороды отдав НАД, Он теряет СО 2. Этому безмерно рад Альфа -кето- глутарат. Окисление грядет: НАД похитит водород, В 1 и липоат С коэнзимом А спешат, Отбирают СО 2. А энергия едва В сукциниле появилась, Сразу АТФ родилась. И остался сукцинат. Вот добрался он до ФАДа - Водороды тому надо. Водороды потеряв, Стал он просто фумарат. Фумарат воды напился, Да в малат и превратился. Тут к малату НАД пришел, Водороды приобрел. ЩУКа снова объявилась И тихонько затаилась Караулить ацетат... Ферменты в этой схеме есть. Коферменты - это НАД, НАДФ, АТФ, ГТФ? Тогда есть. Схема:
Образовавшиеся молекулы ЩУК реагируют с новой молекулой Ацетил-КоА и цикл повторяется вновь. Энергетический баланс одного оборота: 3 НАДН2 + 1 ФАДН2 (направляются далее в дыхательную цепь окислительного фосфорилирования) + 1 ГТФ (НАДН2 -> 3 АТФ, ФАДН2 -> 2 АТФ, ГТФ -> 1 АТФ) = 12 АТФ. Регуляция ЦТК: 4 регуляторных фермента: цитратсинтазы, изоцитрат ДГ, α-КГ ДГ и СДГ. ЦТК ингибируется в основном НАДН2 и АТФ, которые являются продуктами ЦТК и цепи окислительного фосфорилирования. Активируют ЦТК в основном НАД+ и АДФ. Оксидазный путь использования кислорода в клетке - митохондриальное окислительное фосфорилирование. Состав дыхательных комплексов редокс-цепи, локализация и функции, тканевые особенности в детском возрасте. Регуляция. Оксидазный путь использования кислорода в клетке: Протекает в митохондриях, потребляет 90% О2 и обеспечивает процесс окислительного фосфорилирования. Окислительное фосфорилирование - синтез АТФ из АДФ и Н3РО4 за счет энергии движении электронов по дыхательной цепи. Оно является основным источником АТФ в аэробных клетках Окислительное фосфорилирование состоит из процессов окисления и фосфорилирования. 1) Процесс окисления Процесс окисления происходит при движении электронов по дыхательной цепи от субстратов тканевого дыхания на кислород. Дыхательная цепь окислительного фосфорилирования состоит из 4 белковых комплексов, встроенных во внутреннюю мембрану митохондрий и небольших подвижных молекул убихинона и цитохрома С, которые циркулируют в липидном слое мембраны между белковыми комплексами.
a. Комплекс I – НАДН2 дегидрогеназный комплекс – самый большой из дыхательных ферментных комплексов, в качестве коферментов содержит ФМН и 5 железосерных (Fe2S2 и Fe4S4) белков. b. Комплекс II – СДГ. В качестве коферментов содержит ФАД и железосерный белок. c. Комплекс III – Комплекс b-c1 (фермент QH2 ДГ). Каждый мономер содержит 3 гема, связанных с цитохромами b562, b566, с1, и железосерный белок. d. Комплекс IV – Цитохромоксидазный комплекс. Каждый мономер содержит 2 цитохрома (а и а3) и 2 атома меди. e. Коэнзим Q (убихинон). Переносит по 2Н+ и 2е-. f. Цитохром С. Периферический водорастворимый мембранный белок. Содержит молекулу гема. Этапы движения е- по дыхательной цепи a. 2е- от НАДН2, проходят через I комплекс (ФМН→SFe белок) на КоQ, высвобождаемая при этом энергия обеспечивает перекачку Н+. b. КоQ с 2е- забирает у воды 2Н+ из матрикса и превращается в КоQН2 (восстановление КоQ проходит также с участием комплекса II). c. КоQН2 переносит 2е- на комплекс III, а 2Н+ в межмембранное пространство. d. Цитохром С переносит е- c III комплекса на IV комплекс. e. IV комплекс сбрасывает е- на О2, высвобождаемая при этом энергия обеспечивает перекачку Н+. Образовавшийся на внутренней мембране митохондрий электрохимический потенциал используется для: a. фосфорилирования АДФ в АТФ; b. транспорта веществ через мембрану митохондрий; c. теплопродукцию. 2) Процесс фосфорилирования Процесс фосфорилирования осуществляется АТФ-синтетазой (Н+-АТФ-аза), которая потребляет 40-45% свободной энергии, выделившейся при окислении. Н+-АТФ-аза интегральный белок внутренней мембраны митохондрий, она состоит из 2 белковых комплексов F0 и F1. a. Гидрофобный комплекс F0 погружён в мембрану и служит основанием, которое фиксирует АТФ-синтазу в мембране. Он состоит из нескольких субъединиц, образующих канал, по которому протоны переносятся в матрикс. b. Комплекс F1 выступает в митохондриальный матрикс. Он состоит из 9 субъединиц (3α, 3β, γ, δ, ε). Субъединицы α и β уложены попарно, образуя «головку»; между а- и β-субъединицами располагаются 3 активных центра, в которых происходит синтез АТФ; γ, δ, ε – субъединицы связывают комплекс F1, с F0. АТФ-синтетаза обеспечивает обратимое взаимопревращение энергии электрохимического потенциала и энергии химических связей. Электрохимический потенциал внутренней мембраны заставляет Н+ двигаться из межмебранного пространства по каналу АТФ-синтазы в матрикс митохондрий. При каждом переносе протонов через канал Fo энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация а- и β-субъединиц и все 3 активных центра, образованных парам α- и β-субъединиц, катализируют очередную фазу цикла: 1) связывание АДФ и Н3РО4; 2) образование фосфоангидридной связи АТФ; 3) освобождение конечного продукта АТФ.
|
||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 994; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.157.241 (0.008 с.) |