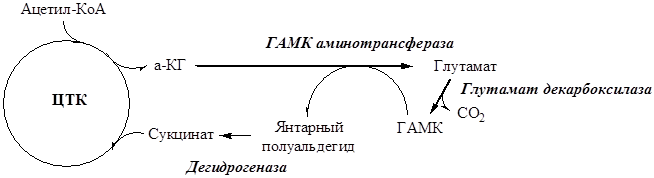Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Защита клеток от действия протеазСодержание книги
Поиск на нашем сайте
Клетки поджелудочной железы защищены от действия пищеварительных ферментов тем, что: · эти ферменты образуются в клетках поджелудочной железы в неактивной формеи активируются только после секреции в просвет кишечника. · в клетках поджелудочной железы присутствует белок-ингибитор трипсина, образующий с В полости желудка и кишечника протеазы не контактируют с белками клеток, поскольку слизистая оболочка покрыта слоем слизи, а каждая клетка содержит на наружной поверхности плазматической мембраны полисахариды, которые не расщепляются протеазами и тем самым защищают клетку от их действия. Разрушение клеточных белков протеазами происходит при язвенной болезни желудка или двенадцатиперстной кишки. ВСАСЫВАНИЕ АМИНОКИСЛОТ В КИШЕЧНИКЕ Всасывание L-аминокислот (но не D) — активный процесс, в результате которого аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь. Известно пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот: 1. нейтральных, короткой боковой цепью (аланин, серии, треонин); 2. нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолейцин); 3. с катионными радикалами (лизин, аргинин); 4. с анионными радикалами (глутаминовая и аспарагиновая кислоты); 5. иминокислот (пролин, оксипролин). Существуют 2 основных механизма переноса аминокислот: симпорт с натрием и γ-глутамильный цикл. 1. Симпорт аминокислот с Na+. Симпортом с Nа+ переносятся аминокислоты из первой и пятой группы, а также метионин.
L-аминокислота поступает в энтероцит путём симпорта с ионом Na+. Далее специфическая транслоказа переносит аминокислоту через мембрану в кровь. Обмен ионов натрия между клетками осуществляется путём первично-активного транспорта с помощью Na+, К+-АТФ-азы. 2. γ-Глутамильный цикл. γ-глутамильный цикл переносит некоторые нейтральные аминокислоты (фенилаланин, лейцин) и аминокислоты с катионными радикалами (лизин) в кишечнике, почках и, по-видимому, мозге. В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные — в цитозоле. Мембранно-связанный фермент γ-глутамилтрансфераза (гликопротеин) катализирует перенос γ-глутамильной группы от глутатиона на транспортируемую аминокислоту и последующий перенос комплекса в клетку. Амнокислота отщепляется от у-глутамильного остатка под действием фермента у-глутамилциклотрансферазы. Дипептид цистеинилглицин расщепляется под действием пептидазы на 2 аминокислоты — цистеин и глицин. В результате этих 3 реакций происходит перенос одной молекулы аминокислоты в клетку (или внутриклеточную структуру). Следующие 3 реакции обеспечивают регенерацию глутатиона, благодаря чему цикл повторяется многократно. Для транспорта в клетку одной молекулы аминокислоты с участием у-глутамильного цикла затрачиваются 3 молекулы АТФ.
Поступление аминокислот в организм осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 30—50 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Аминокислоты при всасывании конкурируют друг с другом за специфические участки связывания. Например, всасывание лейцина (если концентрация его достаточно высока) уменьшает всасывание изолейцина и валина. 50.Реакции декарбоксилирования аминокислот: образование биогенных аминов, биологическое значение. Синтез, ГАМК, серина, аминоэтанола, холина, гистамина в тучных клетках соединительной ткани, значение биогенных аминов ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ И ИХ ПРОИЗВОДНЫХ Некоторые АК и их производные могут подвергаться декарбоксилированию – отщеплению α-карбоксильной группы. У млекопитающих декарбоксилируются: три, тир, вал, гис, глу, цис, арг, орнитин, SAM, ДОФА, 5-окситриптофан и т.д. Реакцию необратимо катализируют декарбоксилазы, которые содержат в активном центре пиридоксальфосфат. Механизм реакции похож на реакцию переаминирования. Продуктами реакции являются СО2 и биогенные амины, выполняющие регуляторные функции (гормоны, тканевые гормоны, нейромедиаторы). Серотонин Серотонин образуется из три в надпочечниках, ЦНС и тучных клетках.
ГАМК ГАМК образуется и разрушается в ГАМК-шунте ЦТК в высших отдела мозга. Он имеет очень высокую концентрацию.
ГАМК – тормозной нейромедиатор (повышает проницаемость постсинаптических мембран для К+), повышает дыхательную активность нервной ткани, улучшает кровоснабжение головного мозга. Гистамин Гистамин образуется в тучных клетках. Секретируется в кровь при повреждении ткани, развитии иммунных и аллергических реакций.
Гистамин – медиатор воспаления, аллергических реакций, пищеварительный гормон: 1. стимулирует секрецию желудочного сока, слюны; 2. повышает проницаемость капилляров, расширение сосудов, покраснение кожи, вызывает отеки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль); 3. сокращает гладкую мускулатуру легких, вызывает удушье; 4. вызывает аллергическую реакцию; 5. нейромедиатор; 6. медиатор боли. Дофамин Дофамин образуется (фен → тир → ДОФА → дофамин) в мозге и мозговом веществе надпочечников.
Дофамин – нейромедиатор среднего отдела мозга. 51.Реакции дезаминирования в организме человека (переаминирование, окислительное дезаминирование глутамата), биологическое значение. Ферменты АЛТ, АСТ, органная Дезаминирование АК — реакция отщепления α-аминогруппы от АК, в результате чего образуется соответствующая α-кетокислота и выделяется молекула аммиака. Дезаминирование бывает прямым и непрямым. Прямое дезаминирование АК Прямое дезаминирование - это дезаминирование, которое происходит в 1 стадию с участием одного фермента. Прямому дезаминированию повергаются глу, гис, сер, тре, цис. Существует 5 видов прямого дезаминирования АК: 1. окислительное; 2. неокислительное; 3. внутримолекулярное; 4. восстановительное; 5. гидролитическое. Окислительное дезаминирование -самый активный вид прямого дезаминирования АК. 1. Глутаматдегидрогеназа (глу-ДГ) - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД), содержит кофермент НАД+. Глу-ДГ катализирует обратимое дезаминирование глу, очень активна в митохондриях клеток практически всех органов, кроме мышц. Глу-ДГ аллостерически ингибируют АТФ, ГТФ, НАДH2, активирует избыток АДФ. Индуцируется Глу-ДГ стероидными гормонами (кортизолом). Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование α-иминоглутарата, затем — неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется α-кетоглутарат. При избытке аммиака реакция протекает в обратном направлении (как восстановительное аминирование α-кетоглутарата).
Глу + НАД+ + Н2О ↔ α-КГ + НАДН2 + NH3 Оксидаза L-аминокислот В печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-аминокислоты:
Оксидаза L-АК имеет кофермент ФМН. Т.к. оптимум рН оксидазы L-АК равен 10,0, активность фермента очень низка и вклад ее в дезаминирование незначителен. Оксидаза D-аминокислот Оксидаза D-аминокислот также обнаружена в почках и печени. Это ФАД-зависимый фермент, с оптимумом рН в нейтральной среде. Оксидаза D-аминокислот превращает, спонтанно образующиеся из L-аминокислот, D-аминокислоты в кетокислоты.
|
||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 291; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.144.109 (0.008 с.) |



 Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.
Серотонин – возбуждающий нейромедиатор средних отделов мозга (проводящих путей) и гормон. Стимулирует сокращение гладкой мускулатуры, вазоконстриктор, регулирует АД, температуру тела, дыхание, антидепрессант.