
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обратимые и необратимые процессы. Круговые процессы (циклы) и их изображение на термодинамической диаграмме. Принцип Томпсона. Тепловые двигатели и холодильные машины.Содержание книги
Похожие статьи вашей тематики
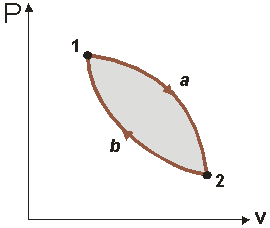
Поиск на нашем сайте Обратимые и необратимые процессы. Обратимые и необратимые процессы, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым. Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия,теплопроводность, вязкое течение и другое Циклы и их изображение. Ряд последовательных термодинамических процессов, представляющих собой один замкнутый, называется круговым термодинамическим процессом или циклом. При однократном расширении газа в цилиндре можно получить лишь ограниченное количество работы, так как при любом процессе расширения все же наступит момент, когда температура и давление рабочего тела станут равными температуре и давлению окружающей среды и на этом прекратится получение работы. Для повторного получения работы необходимо осуществить процесс сжатия и возвратить рабочее тело в первоначальное состояние. Таким образом, для непрерывного производства работы рабочее тело должно участвовать в круговом термодинамическом процессе (рис.1).
Рис. 1
Циклы могут быть обратимыми, состоящими из обратимых процессов, и необратимыми. В основе анализа эффективности современных тепловых машин лежат обратимые циклы, т.е. идеальные циклы, не учитывающие потери на трение и т.д. Циклы подразделяются на прямые и обратные. Прямыми называются циклы, в которых теплота преобразуется в работу, обратными – в которых теплота передается от более холодного тела к более нагретому. При изображении циклов на термодинамических диаграммах последовательный обход процессов в прямом цикле происходит по часовой стрелке (см. рис.1), в обратном цикле – против часовой стрелки. Для всех циклов очевидным является условие: так как цикл начинается и заканчивается в одной точке. Тогда первый закон термодинамики для цикла запишется следующим образом: где Qц – теплота, участвующая в цикле, равная алгебраической сумме количеств теплоты для каждого процесса; Lц – работа цикла (цикловая работа), равная соответственно алгебраической сумме работ в каждом процессе.
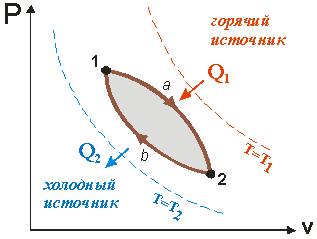
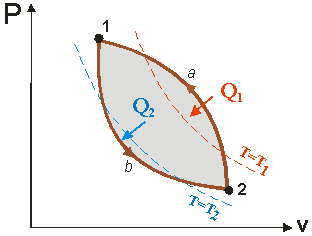
Прямой цикл. Прямой цикл – это цикл двигателя. В этом цикле происходит преобразование теплоты в механическую работу (рис.2).
Рис.2
В процессе 1а2 к рабочему телу от горячего источника температурой Т1 подводится теплота Q1 и совершается положительная работа. В процессе 2b1 от рабочего тела к холодному источнику температурой Т2 отводится количество теплоты Q2 и совершается отрицательная работа. Количество работы в процессе расширения L1a2 , больше, чем работа сжатия L2b1, и цикловая работа будет положительна и равна: На рисунке работа цикла изображается площадью фигуры пл.1-а-2-b-1. В соответствии с первым законом термодинамики для цикла: Для оценки эффективности преобразования теплоты в работу в прямом цикле используют термический коэффициент полезного действия (КПД), под которым понимают отношение работы, полученной в цикле, к затраченной теплоте: Таким образом, термический КПД показывает какая часть теплоты, подведенной к циклу от нагревателя, превращена в полезную работу. Согласно второму закону термодинамики эта величина всегда меньше единицы (<100%). Обратный цикл. Обратный цикл служат для производства холода или теплоты. В нем рабочее тело переносит теплоту от холодного источника к горячему. Для совершения такого несамопроизвольного процесса затрачивается работа цикла. Обратные циклы реализуются в холодильных машинах и тепловых насосах (рис.3).
Рис.3 В процессе расширения 1а2 температура рабочего тела ниже Т2,в результате чего от холодного источника к рабочему телу передаётся количество теплоты Q2. В процессе сжатия 2в1 температура рабочего тела выше Т1 и горячему источнику от рабочего тела передаётся количество теплоты Q1. Так как на процесс сжатия работы затрачивается больше и она отрицательна, работа цикла будет равна: Первый закон термодинамики имеет вид: Для оценки работы холодильных машин применяется так называемый холодильный коэфф ициент, определяемый отношением полезной теплоты Q2, отнятой от холодного источника ограниченной емкости, к затраченной работе: В холодильной машине теплота Q1 выбрасывается в окружающую среду – источник неограниченной емкости. Машины, основным продуктом производства которых является теплота Q1, передаваемая в источник ограниченной емкости, называются тепловыми насосами. Эффективность работы в этом случае оценивается отопительным коэффициентом, представляющим собой отношение теплоты Q1, переданной потребителю, к затраченной работе: В цикле теплового насоса теплота Q2 отбирается от источника неограниченной емкости (например, атмосфера). Значения холодильного и отопительного коэффициентов могут изменяться в широких пределах 0 ≤ ε,φ < ∞.
Принцип Томпсона. Исторически открытие второго закона термодинамики связано с изучением вопроса о максимальном коэффициенте полезного действия тепловых машин. В связи с этим одна из формулировок второго начала принадлежит Томсону (лорд Кельвин). Он утверждал: "Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара". Тепловые двигатели и холодильные машины. Тепловой двигатель - это периодически действующий двигатель, совершающий работу за счет полученной извне теплоты. Термостатом называется термодинамическая система, которая может обмениваться теплотой с телами практически без изменения собственной температуры. Рабочее тело - это тело, совершающее круговой процесс и обменивающееся энергией с другими телами. Принцип работы теплового двигателя: от термостата с более высокой температурой T1, называемого нагревателем, за цикл отнимается количество теплоты Q1, а термостату с более низкой температурой T2, называемому холодильником, за цикл передается количество теплоты Q2. При этом совершается работа A=Q1-Q2 (рис. 18).
Термический КПД двигателя:
η=A/Q1=(Q1-Q2)/Q1=1-(Q2-Q1)
Чтобы КПД был равен 1, необходимо, чтобы Q2=0, а это запрещено вторым началом термодинамики. Процесс, обратный происходящему в тепловом двигателе, используется в холодильной машине: от термостата с более низкой температурой T2 за цикл отнимается количество теплоты Q2 и отдается термостату с более высокой температурой T1. При этом Q=Q1-Q2=A или Q1=Q2+A. Количество теплоты Q1, отданное системой термостату T1, больше количества теплоты Q2, полученного от термостата T2, на величину работы, совершенной над системой. Эффективность холодильной машины характеризует холодильный коэффициент η' - отношение отнятой от термостата с более низкой температурой количества теплоты Q2 к работе A, которая затрачивается на приведение холодильной машины в действие:
η'=Q2/A=Q2/(Q1-Q2). (69)
|
||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 1005; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.01 с.) |

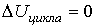 ,
,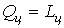 ,
,
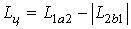 .
.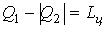 .
.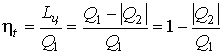 .
. 
 .
.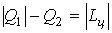 .
.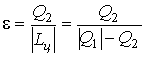 .
.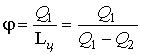 .
.



