
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа газа при изменении его объема. Количество теплоты. Теплоемкость.Содержание книги
Похожие статьи вашей тематики
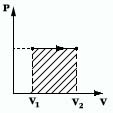
Поиск на нашем сайте Работа газа.
Количество теплоты. Q - энергия, которую тело теряет или приобретает при передаче тепла. Формулы количества теплоты при некоторых процессах:
Количество теплоты всегда передается о т более горячих тел к более холодным до достижения ими одинаковой температуры (теплового равновесия), если нет иных процессов, кроме теплопередачи. Полезные формулы:
Теплоёмкость. ТЕПЛОЁМКОСТЬ - кол-во теплоты; поглощаемой телом при нагревании на 1 градус (1 °С или 1 К); точнее - отношение кол-ва теплоты, поглощаемой телом при бесконечно малом изменении его темп-ры, к этому изменению. Т. единицы массы вещества наз. удельной Т., 1 моля вещества-молярной (мольной) Т. Единицами Т. служат Дж/(кг · К), ДжДмоль · К), Дж/(м3 · К) и внесистемная единица кал/(моль·К). Кол-во теплоты, поглощённой телом при изменении его состояния, зависит не только от начального и конечного состояний (в частности, от их темп-ры), но и от способа, к-рым был осуществлён процесс перехода между ними. Соответственно от способа нагревания тела зависит и его Т. Обычно различают Т. при пост. объёме (CV)и Т. при пост. давлении (СP), если в процессе нагревания поддерживаются постоянными соответственно объём тела или давление. При нагревании при пост. давлении часть теплоты идёт на производство работы расширения тела, а часть - на увеличение его внутренней энергии, тогда как при нагревании при пост. объёме вся теплота расходуется на увеличение внутр. энергии; в связи с этим СР всегда больше, чем CV. Для газов (разреженных настолько, что их можно считать идеальными) разность мольных Т. СP - CV= R, где R - универсальная газовая постоянная,равная 8,314 Дж/(Дмоль·К) или 1,986 калДмоль·К). У жидкостей и твёрдых тел разница между СР и CV сравнительно мала. Т. Из 1-го и 2-го начал термодинамики следует, что Теоретич. вычисление Т., в частности её зависимости от темп-ры тела, не может быть осуществлено при помощи чисто термодинамич. методов и требует применения методов статистической физики (знания микроструктуры вещества). Для газов вычисление Т. сводится к вычислению ср. энергии теплового движения отд. молекул. Это движение складывается из поступат. и вращат. движений молекулы как целого и из колебаний атомов внутри молекулы.
|
||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 949; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.007 с.) |


 Количество теплоты при нагревании и охлаждении.
Количество теплоты при нагревании и охлаждении. Количество теплоты при плавлении или кристаллизации.
Количество теплоты при плавлении или кристаллизации. Количество теплоты при кипении, испарении жидкости и конденсации пара.
Количество теплоты при кипении, испарении жидкости и конденсации пара. Количество теплоты при сгорании топлива.
Количество теплоты при сгорании топлива. Количество теплоты, переданное телу,
Количество теплоты, переданное телу,  т. е. Т. пропорц. производной от энтропии S системы по темп-ре Т при соответствующих условиях.
т. е. Т. пропорц. производной от энтропии S системы по темп-ре Т при соответствующих условиях.


