Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Качественные реакции аминокислот.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Нингидриновая реакция, цветная реакция, применяемая для качественного и количественного определения аминокислот, иминокислот и аминов. При нагревании в щелочной среде нингидрина (трикетогидринденгидрата, С9НбО4) с веществами, имеющими первичные аминогруппы (—NH2), образуется продукт, который имеет устойчивую интенсивную сине-фиолетовую окраску с максимальным поглощением около 570 нм. Т. к. поглощение при этой длине волны линейно зависит от числа свободных аминогрупп, Нингидриновая реакция послужила основой для их количественного определения методами колориметрии или спектрофотометрии. Эта реакция используется также для определения вторичных аминогрупп (>NH) в иминокислотах — пролине и оксипролине; в этом случае образуется продукт ярко-жёлтого цвета. Чувствительность — до 0,01%. Современный автоматический аминокислотный анализ проводят, сочетая ионообменное разделение аминокислот и количественное определение их с помощью нингидриновой реакции. При разделении смесей аминокислот методом бумажной хроматографии позволяет определять каждую аминокислоту в количестве не менее 2—5 мкг.
По интенсивности окраски можно судить о количестве аминокислот. Эта реакция положительна не только со свободными аминокислотами, но и пептидами, белками и др. Ксантопротеиновая реакция позволяет обнаружить ароматические аминокислоты (фенилаланин, тирозин, гистидин, триптофан), основана на реакции электрофильного замещения в ароматическом ядре (нитрование).
При действии концетрированной азотной кислоты, например, на тирозин образуется продукт, окрашенный в желтый цвет.
Биуретовая реакция - используется как цветная реакция на белки. В щелочной среде в присутствии солей меди(II) они дают фиолетовое окрашивание. Окраска обусловлена образованием комплексного соединения меди(II), за счет пептидной группы -СО-NH-, которая характерна для белков. Свое название эта реакция получила от производного мочевины - биурета, который образуется при нагревании мочевины с отщеплением аммиака: Кроме белков и биурета такое же окрашивание дают и другие соединения, содержащие -эту группу: амиды, имиды карбоновых кислот, а также соединения, содержащие в молекуле группы -CS-NH- или =CH-NH-. Также реакцию дают белки, некоторые аминокислоты, пептиды, биурет и средние пептоны. Цвет комплекса, получаемый при биуретовой реакции с различными пептидами, несколько отличается и зависит от длины пептидной цепи. Пептиды с длиной цепи от четырех аминокислотных остатков и выше образуют красный комплекс, трипептиды - фиолетовый, а дипептиды - синий.
кетонная форма полипептида
енольная форма полипептида Образование пептидной связи. Межмолекулярное взаимодействие -аминокислот приводит к образованию пептидов. При взаимодействии двух -аминокислот образуется дипептид.
Межмолекулярное взаимодействие трех -аминокислот приводит к образованию трипептида и т.д.
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH - пептидной связью. 22. Декарбоксилирование α-аминокислот – образование биогенных аминов и биорегуляторов (гиста-мин, триптамин).
Реакции декарбоксилирования необратимы и катализируются ферментами декарбоксилазами. Простетическая группа декарбоксилаз в клетках животных - пиридоксальфосфат. Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биологически активными веществами. Они выполняют функцию нейромедиаторов (серотонин, дофамин, ГАМК и др.), гормонов (норадреналин, адреналин), регуляторных факторов местного действия (гистамин, карнозин, спермин и др.). Гистамин образуется при декарбоксилировании аминокислоты гистидина. Он синтезируется в тучных клетках, накапливается в секреторных гранулах, выделяется при раздражении клеток.
Гистамин оказывает разнообразные биологические эффекты: вызывает расширение сосудов, снижает артериальное давление, увеличивает тканевую проницаемость, вызывает местный отёк, стимулирует желудочную секрецию, обладает бронхоспатическим эффектом. В высокой концентрации он является медиатором воспалительных и аллергических реакций. Серотонин образуется при декарбоксилировании гидрокситриптофана. Он синтезируется в хромаффиннных клетках, в некоторых ядрах подкорковых структур, тромбоцитах.
Эффекты серотонина: вызывает спазм сосудов, повышение артериального давления, стимулирует перистальтику кишечника, участвует в терморегуляции, в механизмах сна, является источником для синтеза гормона мелатонина, влияет на психические реакции человека. Так, при шизофрении наблюдается нарушение обмена серотонина. Катехоламины (дофамин, адреналин, норадреналин) синтезируются из аминокислоты тирозина.
Дофамин – возбуждающий медиатор, при его дефиците развивается болезнь Паркинсона (адинамия, ригидность, тремор). Адреналин вызывает спазм сосудов, повышают артериальное давление, стимулирует работу сердца, является гормоном. Норадреналин в основном выполняет нейромедиаторные функции. Полиамины (спермин, спермидин) синтезируются из орнитина и метионина, входят в состав хроматина, участвует в регуляции процессов трансляции, транскрипции, репликации. Так как биогенные амины очень активны, они быстро инактивируются в тканях. Распад биогенных аминов осуществляется несколькими способами: окисление, метилирование, дезаминирование. Основным способом инактивации биогенных аминов является окислительное дезаминирование под действием ферментов аминооксидаз (моноаминооксидаз, полиаминооксидаз).
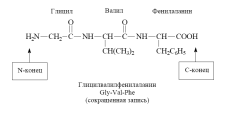
Аминокислоты могут ковалентно связываться друг с другом с помощьюпептидных связей. Карбоксильная группа одной аминокислоты ковалентно связывается с аминогруппой другой аминокислоты. При этом возникает R-CO-NH-R связь, называемая пептидной связью. При этом происходит отщепление молекулы воды.
|
||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 2249; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.181.112 (0.007 с.) |