Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронные эффекты в молекулах: виды и механизм передачи. Классификация органиче-ских реакций.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
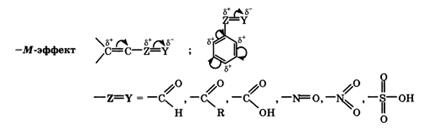
Электронные эффекты - смещение электронной плотности в молекуле,ионе или радикале под влиянием заместителей. Заместителем считается любой атом (кроме водорода) или группа атомов,связанная с атомом углерода. Различают индуктивный и мезомерный электронные эффекты заместителей.
+М-эффект характерен для групп -OH и -NH2. -М-эффект проявляют заместители с электроотрицательными атомами и смещающие электронную плотность на себя. -М-эффект характерен для групп -CH=O, -COOH, -NO2. Хотя эти группы имеют неподеленные электронные пары,пространственное расположение орбиталей с этими электронами не позволяет им вступать в систему сопряжения. Таким образом, в данном случае заместитель может лишь оттягивать электроны из общей системы сопряжения за счет своей более высокой электроотрицательности.
Вопрос 9 Кислотность и основность органических соединений. Для оценки кислотности и основности органических соединений наибольшее значение имеют две теории – теория Бренстеда и теория Льюиса. По теории Льюиса кислотные и основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием связи. В соответствии с принципом ЖМКО кислоты и основания Льюиса делятся на жесткие и мягкие. Кислотами Льюиса могут быть атомы, молекулы или катионы, обладающие вакантной орбиталью и способные принимать пару электронов с образованием ковалентной связи. Кислоты Льюиса – акцепторы пары электронов; основания Льюиса – доноры пары электронов. Основания Льюиса (атом, молекула или анион) должны обладать по крайней мере одной парой валентных электронов, которую они способны предоставить партнеру для образования ковалентной связи. Все основания Льюиса представляют собой нуклеофильные реагенты. По теории Бренстеда (протолитической теории) кислотность и основность соединений связывается с переносом протона Н+. Кислота и основание образуют сопряженную кислотно-основную пару, в которой чем сильнее кислота, тем слабее сопряженное ей основание, и напротив, чем сильнее основание, тем слабее сопряженная ему кислота. Кислоты Бренстеда (протонные кислоты) – нейтральные молекулы или ионы, способные отдавать протон (доноры протонов).
Основания Бренстеда – нейтральные молекулы или ионы, способные присоединять протон (акцепторы протонов). Кислотность и основность являются не абсолютными, а относительными свойствами соединений: кислотные свойства обнаруживаются лишь в присутствии основания; основные свойства – только в присутствии кислоты. В качестве растворителя при изучении кислотно-основных равновесий обычно используется вода. В зависимости от природы элемента, с которым связан протон, различают ОН- кислоты (карбоновые кислоты, фенолы, спирты), SH-кислоты (тиолы), NН-кислоты (амины, амиды, имиды), СН-кислоты (углеводороды и их производные). Элемент и связанный с ним атом водорода называют кислотным центром. Во всех случаях присутствует сдвиг электронной плотности от атома водорода к более электроотрицательному атому, протону более или менее легко отщепиться. Чем выше электроотрицательность элемента, с которым связан протон, тем больше кислотность соединения (так, карбоновые кислоты являются более сильными кислотами, чем тиолы или амины). Наличие в молекуле электроноакцепторных групп, обладающих отрицательными электронными эффектами, увеличивает положительный заряд на протоне, что приводит к усилению кислотных свойств. Для образования ковалентной связи с протоном основания Бренстеда должны предоставлять либо неподелениую пару электронов, либо электроны p-связи. В соответствии с этим основания Бренстеда делятся на п -основания и p-основания. n -основания могут быть нейтральными или отрицательно заряженными. Как правило, анионы обладают более сильно выраженным основным характером, чем нейтральные вещества. То есть амид-ион NН2– или гидроксид-ион НО– по основности превосходят аммиак NН3 и воду Н2О. В p-основаниях, к которым относятся алкены, алкадиены, арены, центром основности, т.е. местом присоединения протона, являются электроны p-связи. Это очень слабые основания, так как протонируемые электронные пары несвободны. Наличие электронодонорных заместителей увеличивает основность органических соединений. 1. Зависимость кислотности от гетероатома. Под природой гетероатома понимают его электроотрицательность (Э.О.) и поляризуемость. Чем больше (Э.О.) тем легче осуществляется гетеролитический разрыв в молекуле. В периодах слева направо с ростом заряда ядра растет (Э.О), т.е. способность элементов удерживать отрицательный заряд. В результате смещения электронной плотности связь между атомами поляризуется. Чем больше электронов и чем больше радиус атома, тем дальше электроны внешнего энергетического уровня расположены от ядра, тем выше поляризуемость и выше кислотность.
Пример: СН- NH- OH- SH-
увеличение Э.О. и кислотности С, N,О – элементы одного периода. Э.О. по периоду растет, кислотность увеличивается. В этом случае поляризуемость влиять на кислотность не будет. Поляризуемость атомов в периоде изменяется незначительно, поэтому главным фактором определяющим кислотность является Э.О. Теперь рассмотрим ОН- SH-
увел-е кислотности О, S – находятся в одной группе, радиус в группе сверху вниз увеличивается, следовательно, растет и поляризуемость атома, что ведет к увеличению кислотности. У S радиус атома больше, чем у О, поэтому тиолы проявляют более сильные кислотные свойства по сравнению со спиртами. 2. Влияние углеводородного радикала и присутствующих в нем заместителей Электроноакцепторные (Э.А.) заместители способствуют делокализации электронной плотности, что ведёт к стабильности аниона и соответственно увеличению кислотности. Электронодонорные (Э.Д.) заместители наоборот способствуют концентрации электронной плотности в кислотном центре, что ведет к понижению кислотности и увеличению основности. Влияние растворителя. Взаимодействие молекул или ионов растворенного вещества с растворителем называется процессом сольватации. Стабильность аниона существенно зависит от его сольватации в растворе: чем больше ион сольватирован, тем он устойчивее, а сольватация тем больше, чем меньше размер иона и чем меньше делокализация в нем отрицательного заряда.
|
||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 1849; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.244.147 (0.011 с.) |