Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Пептиды. Строение пептидной связи. Гидролиз пептидов. Первичная структура белка и методы её установления. Вторичная и третичная структура белка.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Пептиды — семейство веществ, молекулы которых построены из двух и более остатков аминокислот, соединённых в цепь пептидными (амидными) связями —C(O)NH—.При помощи пептидных связей из аминокислот образуются белки и пептиды. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, октапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют «полипептиды», а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками. Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки». Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную C-карбоксильную группу — С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Связь между α-углеродным атомом и α-аминогруппой или α-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации. В организме человека вырабатывается множество пептидов, участвующих в регуляции различных биологических процессов и обладающих высокой физиологической активностью. Такими являются целый ряд гормонов – окситоцин (9 аминокислотных остатков), вазопрессин (9), брадикинин (9) регулирующий тонус сосудов, тиреолиберин (3), антибиотики – грамицидин, пептиды, обладающие обезболивающим действием (энкефалины(5) и эндорфины и другие опиоидные пептиды). Обезболивающий эффект этих пептидов в сотни раз превосходит анальгезирующий эффект морфина; Основным свойством пептидов является их способность к гидролизу. При гидролизе происходит полное или частичное разрушение цепи, после чего образуются пептиды более короткого строения. Полный гидролиз происходит при длительном нагревании пептида с концентрированной соляной кислотой. Гидролиз может быть кислотным и щелочным, а также может протекать под действием ферментов. В кислой и щелочной среде образуются соли аминокислот, а ферментативный процесс протекает селективно, т.к. можно расщепить конкретные фрагменты цепи пептида.
Различают 4 уровня структурной организации белков, называемых первичной, вторичной, третичной и четвертичной структурами. Существуют общие правила, по которым идёт формирование пространственных структур белков. Определение первичной структуры белков сводится к выяснению порядка расположения аминокислот в полипептидной цепочке. Эту задачу решают с помощью метода секвенирования. секвенирование позволяет определить аминокислотную последовательность в полипептидах, размер которых не превышает несколько десятков аминокислотных остатков. Определение первичной последовательности белка сводится к следующим основным этапам: Для специфического расщепления белков по определенным точкам применяются как ферментативные, так и химические методы. Из ферментов, катализирующих гидролиз белков по определенным точкам, наиболее широко используют трипсин и химотрипсин. Трипсин катализирует гидролиз пептидных связей, расположенных после остатков лизина и аргинина. Химотрипсин преимущественно расщепляет белки после остатков ароматических аминокислот - фенилаланина, тирозина и триптофана. Наряду с ферментативными методами используются и химические методы расщепления белков. Для этой цели часто применяют бромциан, расщепляющий белок по остаткам метионина:
Пептидная связь характеризуется следующими свойствами: 1. Четыре атома пептидной связи лежат в одной плоскости, т.е. для пептидной связи характерна компланарность. 2. Атомы О и Н пептидной связи имеют трансориентацию. 3. Длина С-N-связи в пептидной связи, равная 0,13 нм, имеет промежуточное значение между длиной двойной ковалентной связи (0,12нм) и одинарной ковалентной связи (0,15 нм). Следовательно, связь С-Nимеет частично характер двойной связи (л-связи), из чего следует, что вращение вокруг оси С-Nзатруднено. Вторичная структура белка представляет собой способ укладки полипептидной цепи в упорядоченную форму за счет системы водородных связей, т.е. конформацию белковой молекулы. Различают две формы вторичной структуры: спиральную, возникающую в пределах одной полипептидной цепи, и слоисто-складчатую – между смежными полипептидными цепями. Между атомами водорода в пептидной группировке и карбонильным кислородом четвертой от нее аминокислоты возникают внутримолекулярные водородные связи. Эти связи появляются после формирования спирали и закрепляют ее. Совокупность α -спиралей и β -структур является важным критерием, по которому можно судить о степени упорядоченности структуры белковой молекулы, стабильности белков при действии физико-химических факторов сред. Третичная структура белка формируется способом складывания вторичной структуры. Например, свиваясь в клубок, спирали образуют глобулы. Именно такую форму имеют белки, выполняющие роль биологических катализаторов и регуляторов, а также белки, имеющие транспортные функции. Полярные гидрофильные группы в глобуле расположены на ее внешней поверхности, а неполярные гидрофобные группы обращены внутрь глобулы. Благодаря этому наружная поверхность белка гидратируется, что повышает растворимость белка и обусловливает возможность его участия в биохимических реакциях, которые в физиологических условиях протекают в водной среде. Располагаясь рядом, спирали образуют нитевидные структуры, называемые фибриллами. Фибриллярные белки являются основным строительным материалом волос, кожи и мышечных тканей. Третичная структура белка стабилизируется главным образом связями между боковыми группами аминокислотных остатков: дисульфидные и водородные связи, диполярные взаимодействия, силы ван-дер-ваальсова притяжения, электростатические эффекты.
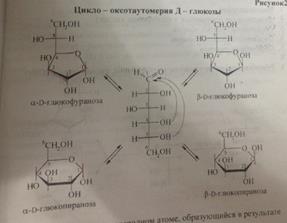
Проекция Хеуорса — распространенный способ изображения циклической структуры моносахаридов в простой трехмерной перспективе.
утолщение линии показывает, что связи находятся ближе к наблюдателю.
25. Строение наиболее важных пентоз (рибоза, ксилоза), гексоз (глюкоза, манноза, галактоза, фрук-тоза), аминосахаров (глюкозамин, маннозамин), дезоксисахаров (2-дезоксирибоза). Их биороль.
Углеводы, например глюкоза, способны окисляться как в аэробных так и анаэробных условиях. Окисление углеводов обеспечивает организм 60% всей легко используемой энергии. 2. Структурная. Примером являются гликозаминогликаны в составе протеогликанов, допустим, хондроитинсульфат, входящий в состав соединительной ткани. 3. Защитная. Гиалуроновая кислота и другие гликозаминогликаны являются основным компонентом трущихся поверхностей суставов, входят в состав слизистых оболочек, находятся в сосудистой стенке. 4. Кофакторная. Например, гепарин входит в состав липопротеинлипазы плазмы крови и ферментов свёртывания крови. 5. Гидроосмотическая. Гетерополисахариды обладают отрицательным зарядом и высокой гидрофильностью. Это позволяет им удерживать молекулы воды, ионы кальция, магния и натрия в межклеточном веществе, обеспечивая необходимую упругость тканей. 6. Пластическая. В комплексе с белками углеводы образуют гормоны, ферменты, секреты слюнных и слизистых желёз. Все простые углеводы (глюкоза, фруктоза) быстро всасываются в желудочно-кишечном тракте и хорошо усваиваются. Сахароза, мальтоза и лактоза могут усваиваться после расщепления их соответствующими ферментами желудочно-кишечного тракта до моносахаридов. Всех медленнее усваивается полисахарид крахмал – предварительно через несколько стадий он должен расщепиться до глюкозы. Пищевые волокна (клетчатка, пектины), частично перевариваясь, в основном транзитом проходят через ЖКТ.
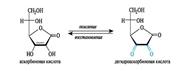
O- и N-глюкозиды. Гидролиз глюкозидов. Фосфаты моносахаридов. Ацилирование аминосаха-ров. Окисление моносахаридов. Получение озазонов глюкозы. Восстановительные свойства аль-доз. Ксилит, сорбит. Аскорбиновая кислота. Гликозиды – производные циклич.форм углеводов, в которых полуацетальная гидроксильная группа заменена группой ОR. Неуглевод.комонент – агликон. Связь между аномерным центром и группой –ОR – гликозидная. Подразделяют на пиранозиды фуранозиды. Гликозиды глюкозы называют глюкозидами, рибозы – рибозидами и т.д.
с а х а р агликон (чаще моносахарид) (спирт, ароматич.соед., стероиды и т.д.)
Гликозид синигрин; гидролиз:
Фосфаты моносахарид. Большое значение имеют эфиры фосфорной кислоты – фосфаты. Они содержатся во всех растительных и животных организмах и представляют собой метаболически активные формы моносахаридов. Наиболее важную роль играют фосфаты D-глюкозы и D-фруктозы.
Окисление глюкозы внейтральной, слабо-кислой среде:
Окисление с помощью сильного окислителя:
Окисление глюкозы в щелочной среде. Р-ция Толленса:
Реакция Фелинга:
Получение озазона глюкозы (р-ция с фенилгидразином):
Восстановление. При восстановлении моносахаридов образуются альдиты.
Альдиты легко растворимы в воде, обладают сладким вкусом, некоторые из них (ксилит и сорбит) используются как заменители сахара для больных сахарным диабетом. При восстановлении альдоз получается лишь один полиол. Ксилит и сорбит – многоатомные спирты. Заменители сахара для больных диабетом.
Аскорбиновая кислота(витамин С).
По структуре близок к моносахаридам. Представляет собой γ-лактон кислоты. Содержится во фруктах, особенно в цитрусовых, ягодах(шиповникэ, черная смородина), овощах, молоке. Проявляет сильные кислотные свойства за счет одной из гидроксильных групп ендиольного фрагмента. При образовании солей γ-лактонное кольцо не размыкается. Обладает сильными восстановительными свойствами. Образующаяся при ее окислении дегидроаскорбиновая кислота легко восстанавливается в аскорбиновую. Этот процесс обеспечивает ряд окислительно-восстановительных реакции в организме.
|
|||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 4314; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.34.96 (0.008 с.) |














 ГЛИКОЗИДЫ
ГЛИКОЗИДЫ Гликозид ванилина; гидролиз:
Гликозид ванилина; гидролиз: