Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Спирты. Номенклатура и классификация спиртов. Химические свойства предельных одноатомных спиртов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Спиртами называют производные углеводородов, содержащие вместо одного или нескольких атомов водорода одну или несколько гидроксигрупп (-OH). Общая формула спиртов, таким образом,R-OH. 1. По числу гидроксильных групп в молекуле спирты разделяют на одноатомные, двухатомные, трехатомные и т.д. до многоатомных. 2. По строению углеводородной цепи спирты разделяют на предельные (насыщенные спирты) и непредельные. 3. По положению гидроксильной группы в цепи различают первичные, вторичные и третичные спирты: При наименовании спиртов по номенклатуре IUPAC находят самую длинную цепь атомов углерода, содержащую гидрокисльную группу, и нумеруют ее с края, к которому ближе гидроксильная группа. После перечисления заместителей добавляется название, соответствующее углеводороду главной цепи с добавлением окончания –ол и цифры, показывающей место гидроксильной группы в цепи. Химические свойства обуславливают гидроксильные группы. Реакции могут протекать в 2х направлениях: Реакции с разрывом О-Н связи: А) действие на спирты минеральных и органических кислот, в результате чего образуются сложные эфиры:
Б) Низшие спирты взаимодействуют с щелочными металлами очень бурно, а с щелочами не реагируют. С ростом радикала скорость реакции падает:
В) Под действием перманганата или дихромата калия спирты окисляются, причем первичные – до альдегидов, а вторичные превращаются в кетоны:
Третичные спирты окисляются с разрывом С-С связи. Реакции с разрывом С-О связи: А) дегидратация. Реакция идет при нагревании и при участии водоотнимающего агента до образования алкена:
Б) Спирты могут реагировать с галогенводородами, причем третичные спирты реагируют очень быстро, а первичные и вторичные - медленно:
6. Образование ацеталей и полуацеталей
3. Кислотные свойства спиртов При взаимодействии с сильными основаниями и щелочными металлами спирты ведут себя как кислоты:
11. Многоатомные спирты: химические свойства. Образование хелатных комплексов как качественная реакция на α-диольный фрагмент. Этиленгликоль, глицерин, инозит. Полиамины: этилендиамин, путресцин, кадаверин. Их биологическая роль.
Кислотные свойства 1. С активными металлами: HO-CH2-CH2-OH + 2Na → H2↑+ NaO-CH2-CH2-ONa (гликолят натрия) 2. С гидроксидом меди(II) – качественная реакция!
Качественной реакцией на двухатомные и многоатомные спирты (диольный фрагмент) является реакция с Си(ОН)2 в щелочной среде, в результате которой образуется комплексное соединение гликолят меди в растворе, дающем синее окрашивание. Упрощённая схема
Основные свойства 1. С галогенводородными кислотами HO-CH2-CH2-OH + 2HCl H+ ↔ Cl-CH2-CH2-Cl + 2H2O С азотной кислотой
Тринитроглицерин - основа динамита Этиленгликольтоксичен – сильный Яд! Угнетает ЦНС и поражает почки. Глицерин (пропантриол-1,2,3) – не ядовит. Без запаха. Хорошо смешивается с водой. Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей. Применяется как компонент мазей для смягчения кожи. Многоатомный циклический спирт инозит относится к витаминоподобным соединениям (витамины группы В) и является структурным компонентом сложных липидов – фосфатидилинозитов. Этилендиамин применяется для получения этилендиаминтетрауксусной кислоты взаимодействием с хлоруксусной кислотой. Его соли с жирными кислотами используются как смягчающие агенты при производстве текстиля. Также этилендиамин применяется в производстве красителей, эмульгаторов, стабилизаторов латексов, пластификаторов и фунгицидов. Этилендиамин токсичен; предельно допустимая концентрация его паров в воздухе составляет 0,001 мг/л. Из полиаминов аиболее известны тетраметилендиамин, или путресцин H2N(CH2)4NH2, и пентаметилендиамин, или кадаверин H2N(CH2)5NH2. Их долгое время считали трупными ядами, т.е. веществами, образующимися при декарбоксилировании диаминокислот и обусловливающими ядовитость гниющих белков.
12. Фенолы.Общая характеристика. Электронное строение карбонильной группы. Реакции нуклеофильного присоединения АN по карбонильной группе. Реакции присоединения воды, синильной кислоты, спиртов, би-сульфита натрия. Механизм альдольной конденсации и реакции Канницаро.
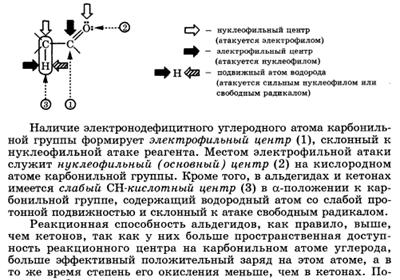
Строение карбонильной группы C=O. · Свойства альдегидов и кетонов определяются строением карбонильной группы >C=O.
Связь С=О сильно полярна. Ее дипольный момент значительно выше, чем у связи С–О в спиртах. Электроны кратной связи С=О, в особенности более подвижные p-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд.
· Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+. В молекулах альдегидов и кетонов отсутствуют атомы водорода, способные к образованию водородных связей. Поэтому их температуры кипения ниже, чем у соответствующих спиртов. Метаналь (формальдегид) - газ, альдегиды С2–C5 и кетоны С3–С4 - жидкости, высшие - твердые вещества. Низшие гомологи растворимы в воде, благодаря образованию водородных связей между атомами водорода молекул воды и карбонильными атомами кислорода. С увеличением углеводородного радикала растворимость в воде падает.
|
||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 1078; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.36.146 (0.01 с.) |





 Если нагрев слабый, то происходит внутримолекулярная дегидратация, в результате чего образуются простые эфиры:
Если нагрев слабый, то происходит внутримолекулярная дегидратация, в результате чего образуются простые эфиры: