Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основное вещество соединительной ткани. Структурная организция межклеточного матриксаСодержание книги
Поиск на нашем сайте
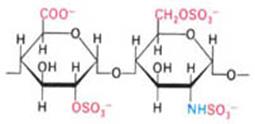
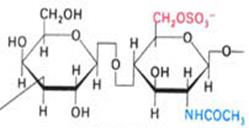
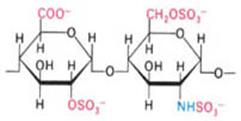
Основное вещество составляет ~30% сухой массы соединительной ткани и состоит из протеогликанов, протеогликановых агрегатов и гликопротеинов. Протеогликаны состоят из корового (от лат. «cor»- сердце) белка и гликозаминогликанов (ГАГ), или мукополисахаридов (старое название). Важнейшими ГАГ соединительной ткани являются гиалуроновая кислота, хондроитинсульфаты, дерматансульфат, кератансульфат, гепарин и гепарансульфат. По химической структуре ГАГ - это гетерополисахариды, линейные неразветвлённые полимерные соединения, построенные из повторяющихся дисахаридных единиц. В составе димеров чаще всего встречаются глюкуроновая кислота или её изомер L-идуроновая кислота, N-ацетилглюкозамин или N-ацетилгалактозамин, галактоза. Основными видами связей в ГАГ являются бета- (1,3) и бета- (1,4)- гликозидные. В упрощённой форме химическая структура различных ГАГ представлена на рис.8. Вместо глюкуроновой кислоты в состав гепарина может входить L-идуроновая кислота. Все ГАГ, кроме гиалуроновой кислоты, сульфатированы и встречаются в организме только в соединении с белками. Они присоединяются О-гликозидной связью к ОН -группам боковых радикалов серина или треонина `корового белка, реже - к амино-группе аспарагина. Гиалуроновая кислота может находиться как к в свободном состоянии, так и в соединении с другими веществами. Это самый высокополимерный гликозаминогликан основного вещества соединительной ткани, имеющий Мг 105-107. Как полианион, гиалуроновая кислота обладает способностью связывать большое количество воды, а также ионы кальция, натрия, калия. Хондроитинсульфаты более гидрофильны, чем кератансульфаты, что сказывается на амортизационных свойствах тех структур, в состав которых они входят. В составе протеогликанов содержится ~ 5 % белков и ~ 95 % ГАГ. Протеогликаны различных тканей имеют свои специфические особенности строения, разный состав ГАГ, но принцип их химического строения одинаков: коровый, или сердцевинный, белок занимает срединное положение, и к нему по всей его длине присоединяются молекулы ГАГ. Коровые белки протеогликанов представлены одной полипептидной цепью разной молекулярной массы. ГАГ присоединяются к коровому белку ковалентными связями. Присоединяясь к линейной структуре гиалуроновой кислоты, протеогликаны образуют очень крупные надмолекулярные структуры - протеогликановые агрегаты (ПГА), составляющие основу (матрикс) соединительной ткани, в который погружены клетки и волокна. Присоединение протеогликанов к гиалуроновой кислоте осуществляется при помощи особых связывающих белков, обладающих гидрофобными свойствами. Гиалуроновая кислота может объединить в ПГА до 200 молекул протеогликанов. Огромные размеры ПГА позволяют наблюдать их в электронном микроскопе. Полимерные цепи ГАГ в составе ПГА как бы распушены за счёт наличия множества одноимённых зарядов и связывания молекул воды полярными группами ГАГ. Схематическое изображение ПГА приведено на рис.9.
1. Гиалуроновая кислота (-D-глюкуроновая кислота -N- ацетилглюкозамин -)n
2. Хондроитин-4-сульфат (- D-глюкуроновая кислота - N- ацетилгалактозамин -4 сульфат-)n 3. Хондроитин -6-сульфат (-D-глюкуроновая кислота - N- ацетилгалактозамин-6-сульфат-)n
4.Дерматансульфат(-L-идуроновая кислота - N-ацетилгалактозамин-4 сульфат-)n
5. Кератансульфат (-D-галактоза - N-ацетилглюкозамин-6-сульфат-)n
6. Гепарин и гепарансульфат (-D-глюкуронил-2-сульфат - N-ацетилглюко-замин-6-сульфат-)n
Рис.8. Структура гликозаминогликанов.
Рис. 9. Схема строения ПГА.
Больше всего протеогликанов содержится в межпозвоночных дисках, хрящах, сухожилиях, связках, менисках, коже, то есть в тех анатомических структурах, которые в значительной мере подвергаются механической нагрузке и деформации. Протеогликаны и ПГА в составе соединительной ткани выполняют следующие биологические функции: 1. Связывают и удерживают воду за счёт наличия большого количества полярных и заряженных функциональных групп ГАГ, которые являются полианионами. 2. Как полианионы протеогликаны и ПГА притягивают и прочно связывают катионы калия и натрия, что обеспечивает их участие в водно - солевом обмене, в поддержании тургора тканей. 3. Образуя структуры типа молекулярных сит (гель), ПГА обеспечивают барьерную функцию соединительной ткани, защищая организм от проникновения микробов, чужеродных молекул, токсинов. 4. Протеогликаны и ПГА участвуют в минерализации костной ткани и твёрдых тканей зуба, т.к. содержат много карбоксильных и сульфатных групп, способных связывать ионы кальция и выполнять роль матриц минерализации. 5. ПГА соединительной ткани обусловливают её амортизационные свойства: при увеличении внешнего давления происходит вытеснение связанной ими воды и сближение одноимённо заряженных цепей ГАГ. После снятия нагрузки исходный объём ПГА восстанавливается. Поэтому больше всего протеогликанов и ПГА содержится в межклеточном веществе межпозвоночных дисков, хрящей, менисков, в сухожилиях, связках и других анатомических образованиях, которые подвергаются механической нагрузке и деформации. 6. В почках протеогликаны, содержащие в своей структуре гепарансульфат, создают фильтрационный барьер для клеток крови, белков и других макромолекул. Компоненты основного вещества соединительной ткани относительно быстро обмениваются, например, период полураспада гиалуроновой кислоты, составляет 2-4 дня, хондроитинсульфатов - в 3-4 раза дольше. Белковая часть протеогликанов синтезируется на рибосомах фибробластов, связанных с эндоплазматической сетью. Пептидная цепь корового белка пронизывает мембрану и растёт в полость эндоплазматической сети, где происходит синтез ГАГ. В нём участвуют УДФ-производные различных моносахаридов: УДФ-глюкоза, УДФ-галактоза, УДФ-глюкуроновая кислота, УДФ-N-ацетилглюкозамин, УДФ-N-ацетилгалактозамин и другие, фосфоаденозинфосфосерная кислота (ФАФС), специфические гликозилтрансферазы: УДФ-галактозилтрансфераза, олигосахаридтрансфераза, УДФ -глюкуронилтрансфераза, сульфотрансфераза и другие. В ходе синтеза протеогликанов к ОН-группам серина корового белка под действием специфической гликозилтрансферазы присоединяется первый моносахарид, затем цепь постепенно удлиняется путём присоединения других моносахаридов с участием соответствующих ферментов по принципу: «один фермент - одна связь», образуется олигосахарид, который постепенно превращается в полисахарид. Фермент олигосахаридтрансфераза осуществляет перенос олигосахарида к амино-группе аспарагина и формирование N-гликозидной связи. После образования полисахаридной цепи происходят различные химические модификации её: сульфирование, превращение остатка глюкуроновой кислоты в идуроновую, сиалирование под действием сиалилтрансфераз и выход молекулы протеогликана из клетки. В межклеточном пространстве молекулы протеогликанов объединяются с гиалуроновой кислотой, образуя протеогликановые агрегаты. Распад протеогликанов и ПГА начинается внеклеточно под действием внеклеточных протеиназ, вызывающих частичную деградацию корового и связывающих белков. Образовавшиеся фрагменты протеогликанов и ПГА поступают в клетки соединительной ткани или переносятся кровью в печень, где заканчивается расщепление белков до аминокислот, ГАГ - до олигосахаридов, а затем - до моносахаридов. В реакциях катаболизма протеогликанов и ПГА участвуют следующие ферменты: катепсины, гиалуронидаза (эндоглюкозидаза), расщепляющая гиалуроновую кислоту на фрагменты; гексозаминидазы, (отщепляют аминосахара), в частности, N-ацетилгалактозаминидаза, бета- глюкуронидаза, бета - галактозидаза, сульфатаза и другие. Структурная организация межклеточного вещества Компоненты межклеточного матрикса, соединяясь между собой и с клетками, образуют единую систему соединительной ткани. Важная роль в этом принадлежит структурным гликопротеидам. Наиболее изученными из них являются фибронектин, ламинин, нидоген. Фибронектин имеет вытянутую форму (длина молекулы 60 нм, ширина - 2 нм) и построен из двух однонаправленных полипептидных цепей, соединённых вблизи С-конца двумя дисульфидными мостиками. В структуре фибронектина выявлено 7-8 доменов, то есть участков молекулы белка, обладающих определённой структурной и функциональной автономией. Фибронектин выполняет интегрирующую роль в организации соединительной ткани, объединяя клетки, волокна, ГАГ, протеогликаны между собой. Это возможно благодаря наличию в его доменах, а также в доменах других структурных гликопротеинов, специфических центров связывания с сиалогликопротеидами и гликолипидами клеточных мембран, с коллагеном, ГАГ и другими компонентами соединительной ткани. Помимо этого молекула фибронектина имеет участок связывания с ферментом трансглютаминазой, которая катализирует реакцию взаимодействия между остатком глютаминовой кислоты одной белковой молекулы и остатком лизина другой, «сшивая» их между собой пептидной связью. Трансглютаминаза соединяет молекулы фибронектина между собой, с коллагеном, с коровыми белками протеогликанов и с другими белками. Клетка имеет центры связывания с фибронектином, а он - с коллагеном, протеогликанами, а также с гликопротеинами плазматических мембран. Структурная организация межклеточного вещества в виде схемы представлена на рисунке 10.
Рис. 10. Структурная организация межклеточного вещества.
Ламинин и нидоген являются гликопротеинами базальных мембран. Базальные мембраны - это тонкие слои, отделяющие клетки от окружающей соединительной ткани, а также слои различных клеток друг от друга. В почечных клубочках базальные мембраны играют роль полупроницаемого фильтра. Особенно важно участие базальных мембран в процессах эмбрионального развития и регенерации. Ламинин состоит из 3х полипептидных цепей, каждая из которых имеет несколько доменов. Домены ламинина содержат центры связывания со всеми структурными компонентами базальных мембран: коллагеном 4-го типа, нидогеном, гепаринсодержащими протеогликанами, фибронектином и др. Кроме того, ламинин имеет несколько центров связывания с клетками. В связи с этим он способен влиять на рост, морфологию, подвижность клеток и их адгезию. Нидоген - это сульфатированный гликопротеин базальных мембран, состоящий из одной полипептидной цепи, которая содержит 3 домена и в их структуре - центры связывания коллагена и ламинина. Таким образом, структурные гликопротеины соединяют между собой клетки, волокна, протеогликаны, объединяя их в единое функциональное целое - соединительную ткань.
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 439; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |